Tierversuchsfreie Hirnforschung
Heutzutage gibt es eine große Bandbreite an seit langem bewährten, aber auch hochmodernen Technologien, die auf menschlichen Daten oder Zellen basieren. Sie ermöglichen effektiv, Mechanismen im menschlichen Gehirn zu verstehen und konkrete Therapien zur Behandlung u.a. neurologischer Erkrankungen des Menschen zu entwickeln.
Tierversuche in der Hirnforschung
Trotz ihrer wissenschaftlichen und ethischen Defizite werden Tierversuche in der Hirnforschung noch immer weitverbreitet eingesetzt, um neurologische Erkrankungen zu erforschen, Therapien zu testen und die Wirkung von Medikamenten zu untersuchen.
Mäuse sind dabei die am häufigsten verwendete Tierart, aber auch Ratten, Zebrafische, Nematoden, Fruchtfliegen, Hamster, Meerschweinchen, Schafe und Affen werden eingesetzt (1). Die Ergebnisse solcher Versuche lassen sich allerdings nicht auf den menschlichen Organismus übertragen, was die Legitimität dieser Methoden infrage stellt (2).
Tatsächlich scheitern bis zu 95% der Medikamente, die in Tierversuchen als erfolgreich getestet gelten, anschließend in klinischen Studien am Menschen (3). In den Bereichen Neurologie und Psychiatrie liegt diese „Durchfallquote“ von Medikamenten sogar noch deutlich höher (4,5).
Grund dafür sind die maßgeblichen biologischen Unterschiede zwischen Mensch und Tier. Diese führen dazu, dass eine auf Tierversuchen basierende Forschung nicht zielführend ist, insbesondere wenn es um die Untersuchung komplexer Systeme wie dem menschlichen Gehirn geht. Um die Effizienz und Relevanz der Forschung zu steigern und bessere Medikamente für den Menschen zu entwickeln, ist ein Umstieg auf tierversuchsfreie Methoden essenziell.
Tierversuchsfreie Methoden
Tierversuchsfreie Methoden, wie beispielsweise Bevölkerungsstudien oder auch elektrophysiologische und bildgebende Verfahren, werden schon seit vielen Jahren in der Hirnforschung eingesetzt und liefern seitdem humanrelevante Ergebnisse für Wissenschaft und Medizin. Zudem ermöglichen innovative Ansätze wie computergestützte Simulationen und Organoide eine immer präzisere Modellierung von menschlichen neuronalen Prozessen, wodurch sich fortlaufend neue, vielversprechende Möglichkeiten in der Forschung ergeben.
Bevölkerungsstudien
Bevölkerungsstudien werden seit dem 19. Jahrhundert eingesetzt und ermöglichen die Erhebung umfangreicher Datensätze, die Zusammenhänge zwischen genetischen, umweltbedingten und lebensstilbezogenen Faktoren sowie unterschiedlichen Aspekten der Gehirnfunktion aufdecken. In diesen Studien werden Personengruppen über Jahre bis Jahrzehnte hinweg beobachtet, oft basierend auf gemeinsamen Merkmalen wie geografischem Wohnort, ethnischem Hintergrund oder sozioökonomischem Status. Diese langfristige Beobachtung hilft, den Einfluss von Lebensstilfaktoren wie Ernährung, Bewegung, oder Alkoholkonsum auf das Gehirn und seine Funktionen zu verstehen und Risikofaktoren für Hirnerkrankungen zu identifizieren.

Bevölkerungsstudien geben Auskunft über Zusammenhänge zwischen genetischen, umweltbedingten und lebensstilbezogenen Faktoren sowie unterschiedlichen Aspekten der Gehirnfunktion.
Ein bedeutender Vorteil von Bevölkerungsstudien ist die Möglichkeit, Risikofaktoren für Erkrankungen wie Alzheimer, Parkinson oder Depression bereits in frühen Phasen zu erkennen, noch bevor klinische Symptome auftreten. Dies ermöglicht eine frühzeitige Intervention, die das Fortschreiten der Krankheit verlangsamen oder sogar verhindern kann.
Ein Beispiel für eine wichtige Entdeckung aus Bevölkerungsstudien ist die Erkenntnis, dass die Ernährung einen wesentlichen Einfluss auf die kognitive Funktion und das Risiko für kognitive Beeinträchtigungen hat (6,7). In einer Studie von 2023 wurde beispielsweise festgestellt, dass Personen, die mehr ultraverarbeitete Lebensmittel konsumierten, einen größeren Rückgang kognitiver Funktionen erlebten als diejenigen, die diese Lebensmittel seltener zu sich nahmen (8).
Ein weiterer bedeutender Zusammenhang, der in einer Studie von 2022 aufgedeckt wurde, ist der zwischen sozialer Isolation, Einsamkeit und einem erhöhten Risiko für Demenz, was die entscheidende Rolle sozialer Bindungen für die Gesundheit des Gehirns unterstreicht (9).
Solche Bevölkerungsstudien sind essenziell, um epidemiologische Trends zu verstehen, Risikofaktoren zu identifizieren und evidenzbasierte Präventions- sowie Behandlungsstrategien zu entwickeln.
Patientenstudien
Studien mit freiwilligen menschlichen Probanden spielen seit Langem eine entscheidende Rolle in der Hirnforschung. Bereits im 19. Jahrhundert wurden erste Patientenstudien durchgeführt, um das menschliche Gehirn zu erforschen. Seit der Entwicklung nicht-invasiver Messmethoden werden diese Studien systematisch zu Forschungszwecken eingesetzt.
Durch Verhaltensstudien, neuropsychologische Tests und bildgebende Verfahren können wertvolle Daten über die Funktion und Struktur des Gehirns gesammelt werden. Solche Untersuchungen ermöglichen es, das menschliche Gehirn in seiner Komplexität zu verstehen und die Mechanismen zu erforschen, die hinter verschiedenen neurologischen und psychischen Erkrankungen stehen.
Ein wichtiger Vorteil dieser Studien ist, dass sowohl gesunde Probanden als auch Patienten mit neurologischen oder psychiatrischen Erkrankungen ein direktes Feedback liefern können. Zudem ermöglichen sie den Vergleich zwischen gesunden und erkrankten Personen, der dabei hilft, spezifische Unterschiede zu erkennen und die Erkrankungen besser zu verstehen.
Bei manchen Patienten, zum Beispiel mit schwerer Epilepsie, werden Elektroden direkt ins Gehirn eingesetzt, um ihre Erkrankung besser behandeln zu können. Diese Elektroden können zusätzlich genutzt werden, um die elektrische Aktivität der Nervenzellen (Neuronen) im Gehirn direkt zu messen. Das bietet einzigartige Einblicke in die Arbeitsweise des Gehirns, die sonst nicht möglich wären.
Durch diese Messungen können Wissenschaftler besser verstehen, wie das Gehirn Informationen verarbeitet und welche Teile für bestimmte Aufgaben zuständig sind. Ein konkretes Beispiel ist eine Untersuchung, bei der Forscher die Aktivität von Neuronen im medialen Temporallappen – einer Region, die für Gedächtnis und Lernen wichtig ist – während einfacher Rechenaufgaben gemessen haben. Sie entdeckten, dass verschiedene Bereiche des Gehirns unterschiedliche Muster zeigen, wenn sie an solchen Aufgaben arbeiten. Das hilft zu verstehen, wie das Gehirn komplexe Vorgänge wie Rechnen steuert und welche Bereiche dabei zusammenarbeiten (10).
Auch spezielle Bluttests können wichtige Informationen über pathologische Gehirnveränderungen liefern. Beispielsweise können über die Analyse von extrazellulären Vesikeln im Blut bestimmte Biomarker erkannt werden, die in Verbindung mit neurologischen und psychiatrischen Erkrankungen, wie Schizophrenie, Epilepsie oder Depression, stehen (11).
Untersuchung von Hirngewebe
Untersuchungen von Hirngewebe, das aus chirurgischen Eingriffen oder von Verstorbenen gewonnen wird, sind von großer Bedeutung (12). Diese Gewebeproben bieten direkte Einblicke in die Anatomie des Gehirns und erlauben es, krankhafte Veränderungen wie Tumore, Entzündungen oder neurodegenerative Erkrankungen wie Alzheimer und Parkinson zu analysieren. Mikroskopische Untersuchungen und molekulare Analysen helfen dabei, die biologischen Grundlagen dieser Erkrankungen zu verstehen und potenzielle therapeutische Ansatzpunkte zu identifizieren.
So wurde in einer post-mortem Studie zum Beispiel die Rolle des Immunsystems bei Schizophrenie analysiert. Bei Schizophrenie-Patienten konnte insbesondere während psychotischer Episoden eine verstärkte Aktivierung von Mikroglia, den Immunzellen des Gehirns, beobachtet werden. Diese Entzündungsprozesse könnten eine Rolle bei der Entwicklung und dem Fortschreiten der Erkrankung spielen, was entzündungshemmende Maßnahmen als mögliche therapeutische Optionen nahelegt (13).
Elektrophysiologische Verfahren
Elektrophysiologische Verfahren ermöglichen es, Gehirnaktivitäten zu messen, ohne in den Körper eingreifen zu müssen. Die sogenannte Elektroenzephalographie (EEG) erfasst elektrische Signale des Gehirns und wurde bereits vor über 100 Jahren erstmalig am Menschen angewendet. In den 60er Jahren wurde anschließend die Magnetenzephalographie (MEG) entwickelt, welche die magnetischen Felder aufzeichnet, die mit den elektrischen Hirnsignalen einhergehen. Beide Methoden werden genutzt, um zu untersuchen, wie das Gehirn arbeitet – sowohl im Ruhezustand als auch bei der Ausführung von Aufgaben, beispielsweise am Monitor. Das funktioniert bei gesunden Menschen ebenso wie bei Personen mit Hirnerkrankungen. Da EEG und MEG völlig unschädlich sind, können sie problemlos bei allen Altersgruppen und ohne Risiko mehrfach angewendet werden. Dadurch können Langzeitbeobachtungen derselben Person durchgeführt werden, wodurch die Entwicklung von Hirnaktivitäten über einen längeren Zeitraum verfolgt werden kann.
Eine moderne Technik, die Echtzeit-Quellenlokalisation, ermöglicht es Gehirnreaktionen in Echtzeit zu beobachten (14). Dies ist besonders nützlich bei Krankheiten wie Epilepsie, da so die schnellen und plötzlichen Veränderungen im Gehirn während eines Anfalls erfasst werden können. Neuere Entwicklungen haben zudem tragbare EEG-Geräte hervorgebracht (15). Durch sie können Gehirnaktivitäten auch im Alltag gemessen werden, fernab der künstlichen Umgebung eines Labors. Mithilfe solcher tragbaren EEG-Geräte wurde in einer Studie beispielsweise gezeigt, dass Gehen und Navigieren in natürlichen Umgebungen unsere Aufmerksamkeit beeinflussen (16). Solche Erkenntnisse sind wichtig, um zu verstehen, wie unser Gehirn in realen Lebenssituationen arbeitet.
Neben EEG und MEG kommen auch andere Verfahren zum Einsatz, um das Gehirn und seine Funktionsweise präzise zu untersuchen. Ein Beispiel ist die transkranielle Magnetstimulation (TMS), die es ermöglicht, vor einer Gehirnoperation wichtige Hirnareale zu identifizieren und in 3D auf bildgebende Verfahren zu übertragen. Diese Technik spielt eine Schlüsselrolle in der prächirurgischen Diagnostik und der Neuronavigation in der Neurochirurgie. Zur erweiterten Diagnostik gehören auch Verfahren wie die Video-Okulographie (VOG). Diese nutzt eine spezielle Brille mit Infrarotkameras, um Augenbewegungen und -störungen aufzuzeichnen und zu analysieren. Sie wird hauptsächlich zur Untersuchung von Schwindel sowie Erkrankungen des Kleinhirns und Hirnstamms eingesetzt. Zusammen mit der Kalorik-Prüfung, bei der durch Warm- und Kaltwasserspülung die Funktion des horizontalen Bogengangs im Innenohr getestet wird, lässt sich das Labyrinth des Innenohrs genau untersuchen.
Durch den vielfältigen Einsatz verschiedener elektrophysiologischer Verfahren in der Forschung und klinischen Praxis wird das Verständnis von Gehirnprozessen kontinuierlich erweitert, was eine präzisere Diagnostik und die Entwicklung neuer therapeutischer Ansätze ermöglicht.
Bildgebende Verfahren

Bildgebende Verfahren werden zur Diagnose und Erforschung von Hirnerkrankungen eingesetzt.
Bildgebende Verfahren wie die Magnetresonanztomographie (MRT) und die Computertomographie (CT) sind essenzielle Werkzeuge in der modernen Medizin, die seit Langem zur Diagnose und Erforschung von Hirnerkrankungen eingesetzt werden. Bereits in den 1970er/80er Jahren wurden diese Verfahren in der Klinik etabliert.
Die MRT nutzt Magnetfelder, um detaillierte Schichtbilder des Gehirns zu erstellen und Veränderungen in der Gehirnstruktur sichtbar zu machen. In der klinischen Anwendung werden diese Bilder mit einer Auflösung von 1 mm erstellt, während in der Forschung eine Auflösung von bis zu 0,02 mm erreicht werden kann. Eine spezielle Form der MRT, die funktionelle MRT (fMRT), misst die Durchblutung verschiedener Hirnregionen, um deren Aktivität während spezifischer Aufgaben zu bestimmen. So lassen sich bestimmte Gehirnbereiche gezielt untersuchen und auffällige Hirnaktivitäten erkennen.
Die CT erstellt, ähnlich wie die MRT, Schichtbilder des Gehirns, verwendet dafür jedoch Röntgenstrahlen anstelle von Magnetfeldern. Hier wird mit einer Auflösung von etwa 0,3 Mikrometern (0,0003 mm) gearbeitet.
Grundsätzlich lassen sich beide Verfahren problemlos mit anderen Diagnose- und Forschungsinstrumenten kombinieren, beispielsweise mit der Positronen-Emissions-Tomographie (PET). Hierbei nutzt man radioaktiv markierte Substanzen, um bestimmte Funktionen des Gehirns sichtbar zu machen, wie zum Beispiel den Stoffwechsel oder die Wirkung von Medikamenten.
In der Medizin werden diese Verfahren oft eingesetzt, um Entzündungen, Tumore oder Erkrankungen wie Demenz, Multiple Sklerose und Schlaganfälle zu diagnostizieren. In der Forschung helfen sie, Hirnerkrankungen besser zu verstehen und effektivere Behandlungsmethoden zu entwickeln. Dank technischer Fortschritte können heute immer kleinere Details im Gehirn erkannt werden, was unser Wissen über diese Erkrankungen stetig erweitert und die Grundlage für zukünftige therapeutische Ansätze schafft (17).
So wurde in einer Studie herausgefunden, dass mithilfe von funktionellen MRT-Daten und maschinellem Lernen individuelle, optimale Parameter für die Tiefenhirnstimulation bei Parkinson-Patienten vorhergesagt werden können (18). Dies könnte die Wirksamkeit der Behandlung verbessern und ermöglicht personalisierte Therapieansätze.
Zellkulturen
Um Hirnfunktionen und -prozesse auf zellulärer Ebene zu erforschen, können menschliche Gehirnzellen im Labor gezüchtet und untersucht werden. Diese Zellen können direkt aus dem Gehirn entnommen werden, beispielsweise während einer Operation, oder aus anderen Zelltypen, wie Haut- oder Blutzellen, gewonnen werden. Letzteres geschieht durch einen Prozess, bei dem diese Zellen in Stammzellen umgewandelt und anschließend zu Gehirnzellen entwickelt werden (19).
Ein wesentlicher Vorteil der Zellkulturen besteht darin, dass sie aus Zellen von Patienten hergestellt werden können, die Informationen ihrer spezifischen Krankheiten in sich tragen. Dies ermöglicht die Entwicklung personalisierter Zellkulturen, die zur Modellierung individueller Erkrankungen und der gezielten Testung von Medikamenten und Therapien verwendet werden können (20). So kann zum Beispiel herausgefunden werden, welche Medikamente für eine bestimmte Person am besten wirken.
Eine wichtige Frage der medizinischen Hirnforschung ist, ob bestimmte Substanzen für das menschliche Gehirn schädlich sind. Dafür haben Forscher spezielle Zellkulturen entwickelt, die helfen, die Auswirkungen von Stoffen wie Pestiziden oder bestimmten Medikamenten zu testen (21,22).
Insgesamt helfen Zellkulturen in der Hirnforschung dabei Prozesse und Wechselwirkungen spezifisch, individuell, und im Detail zu untersuchen. Beispielsweise konnte in einer Studie mit Hilfe von Zellkulturen die Auswirkung einer, mit früheinsetzender Parkinson-Krankheit assoziierten, Mutation auf bestimmte Rezeptoren untersucht werden (23). Diese Ergebnisse können dabei helfen die Krankheit besser zu verstehen und neue Behandlungsmöglichkeiten zu finden. In einer weiteren Studie konnten die molekularen und genetischen Ursachen und Auswirkungen einer Protein-Fehllokalisierung im Zusammenhang mit neurodegenerativen Erkrankungen genauer analysiert werden, wodurch ein potentielles Ziel zur Behandlung verschiedener Demenzerkrankungen gefunden werden konnte (24).
Organoide
Als Organoide bezeichnet man im Labor gezüchtete millimetergroße, dreidimensionale Strukturen, die aus Biopsien, Körperzellen oder induzierten pluripotenten Stammzellen hergestellt werden. Sie bestehen aus verschiedenen organtypischen Zellen und besitzen physiologisch relevante Eigenschaften des eigentlichen Organs. So sind Hirn-Organoide aus verschiedenen Nervenzellarten aufgebaut und ahmen bestimmte Funktionen des Gehirns, wie zum Beispiel Gedächtnis- und Lernfunktionen sowie auch die sensorische Verarbeitung, nach.
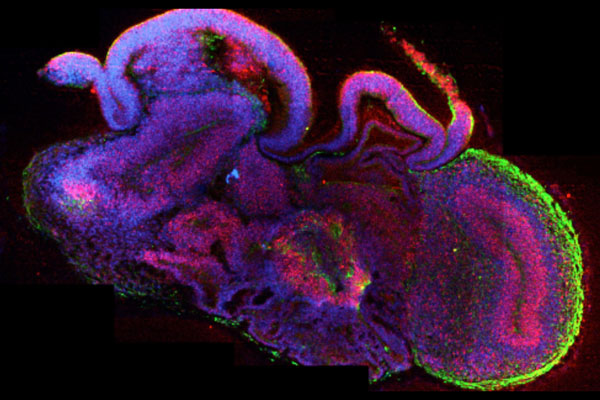
Im Labor gezüchtetes Mini-Gehirn.
Solche sogenannten Mini-Gehirne ermöglichen es auch komplexe Prozesse, wie zum Beispiel die Entwicklung des Gehirns, zu beobachten (25). Sie erlauben es zu untersuchen, wie Gehirnzellen wachsen, sich verbinden und miteinander kommunizieren. Das ist wichtig, um zu verstehen, wie das Gehirn funktioniert und welche Prozesse bei Krankheiten wie Alzheimer oder Autismus gestört sein könnten.
Des Weiteren können Hirn-Organoide verwendet werden, um neue Medikamente in einem komplexen, menschenrelevanten, und personenbezogenen System zu testen. Auf diese Weise kann ohne Eingriffe in den Menschen herausgefunden werden, welche Therapien für Patienten am besten geeignet sind (26).
Mithilfe von Hirn-Organoiden wurde in einer Studie beispielsweise herausgefunden, dass das Pestizid Chlorpyrifos zusammen mit einer bestimmten Genmutation das Risiko erhöhen kann, Autismus zu entwickeln (27). Dies zeigt, dass die Kombination aus bestimmten Chemikalien und genetischen Veränderungen einen Einfluss auf unsere Gehirnentwicklung und potenzielle Schäden haben kann. In einer weiteren Studie wurde untersucht, wie sich Nervenzellen in Hirn-Organoiden von Patienten mit Parkinson-Krankheit und einer Veränderung im sogenannten GBA-Gen entwickeln. Es wurde herausgefunden, dass diese Nervenzellen nicht richtig reifen können, weil es Probleme im Zellzyklus gibt, was zur Entstehung von Parkinson beitragen kann (28).
Neben Organoiden werden in der Forschung auch sogenannte Sphäroide eingesetzt. Diese sind ebenfalls dreidimensionale Zellansammlungen, bestehen jedoch oft aus einer kleineren Anzahl von Zelltypen und sind in der Lage, grundlegende Gewebe- oder Organfunktionen nachzubilden, jedoch in einer weniger komplexen Form. Sie werden häufig genutzt, um Zellverhalten, zelluläre Interaktionen und die Wirkungen von Medikamenten in dreidimensionalen Strukturen zu untersuchen. In der Hirnforschung können Sphäroide verwendet werden, um Aspekte der neuronalen Entwicklung und Veränderungen in Krankheitsmodellen zu erforschen. Durch ihre reduzierte Komplexität im Vergleich zu Organoiden sind sie schneller, einfacher und kostengünstiger herzustellen. Dadurch eignen sie sich beispielsweise hervorragend für Hochdurchsatz-Screenings, in denen große Mengen an Proben schnell auf Wirkstoffe oder Krankheitsmechanismen getestet werden können (29).
Durch die Kombination von Zellmodellen mit Gentechnik können spezifische genetische Veränderungen in den Modellen erzeugt werden, um relevante Krankheitsmechanismen und potenzielle therapeutische Zielstrukturen präziser abzubilden. Darüber hinaus stellen Biobanken eine wertvolle Quelle für menschliche Zellen dar, die als Ausgangsmaterial für die Modellierung von Krankheiten dienen. Die Nutzung dieser Biobanken ermöglicht es, Zellmodelle auf Basis einer Vielzahl genetischer und klinischer Daten zu entwickeln, wodurch Krankheitsmodelle weiter optimiert werden können (30).
Organ-Chips
Organ-Chips sind Werkzeuge, die speziell entwickelt wurden, um physiologische Prozesse in vitro zu beobachten. Verschiedene Organoide können auf einem solchen Chip platziert und in einen künstlichen Flüssigkeitskreislauf, der beispielsweise den Blutkreislauf simulieren kann, eingeschlossen werden (31).
Sogenannte Multi-Organ-Chips erlauben die Kombination mehrerer Organoide auf einem einzelnen Chip, wodurch die Interaktion und Kommunikation dieser Gewebe untersucht werden kann (32).
Auf diese Weise lässt sich etwa auch die Signalübertragung vom Gehirn zu anderen Geweben nachbilden und untersuchen. Dadurch kann herausgefunden werden, welcher Zusammenhang zwischen Störungen in diesem Prozess und verschiedenen neurologischen Erkrankungen besteht.
Ein zentraler Einsatzbereich von Organ-Chips in der Hirnforschung ist die Untersuchung der Blut-Hirn-Schranke (33). Diese Barriere schützt das Gehirn vor schädlichen Substanzen, während sie gleichzeitig den Transport von notwendigen Nährstoffen ermöglicht. Durch die Simulation dieser Barriere in Organ-Chips kann untersucht werden, wie Medikamente oder Schadstoffe die Schranke überwinden. Dies ist besonders relevant für die Entwicklung neuer Therapien, da es Aufschluss darüber gibt, welche Verbindungen potenziell schädlich sind und wie sie sicher ins Gehirn gelangen können.
Ein weiteres bedeutendes Anwendungsfeld von Organ-Chips ist die Erforschung von Veränderungen im Gehirn unter pathologischen Bedingungen (34). Es kann beobachtet werden, wie Nervenzellen auf verschiedene Stressfaktoren reagieren, die mit Störungen wie Entzündungen, neurodegenerativen Erkrankungen oder Krebs in Verbindung stehen. Durch die Untersuchung der Wechselwirkungen zwischen den Zellen und dem Einfluss äußerer Faktoren, können wichtige Mechanismen identifiziert werden, die zur Krankheitsentwicklung beitragen.
Insgesamt ermöglichen Organ-Chips, komplexe biologische Prozesse in einem kontrollierten Umfeld zu untersuchen und helfen, neue Erkenntnisse über die Funktionsweise des menschlichen Gehirns zu gewinnen.
In einer Studie wurde zum Beispiel ein Multi-Organ-Chip entwickelt, der mikrophysiologische Systeme von Darm, Leber und Gehirn miteinander verbindet, um besser zu verstehen, wie diese Organe bei neurodegenerativen Krankheiten zusammenwirken. Es zeigte sich, dass Veränderungen im Darm und der Leber neurodegenerative Prozesse im Gehirn beeinflussen können, was die Bedeutung der Darm-Hirn-Leber-Achse für die Erforschung und Therapie solcher Krankheiten unterstreicht (35).
3D-Biodruck
Durch den Einsatz von 3D-Biodruck können komplexe Gehirnstrukturen realistisch nachgebildet werden. Diese innovative Technologie nutzt lebende Zellen, um Gewebe zu erzeugen, das sowohl die Architektur als auch die Funktion des menschlichen Gehirns simuliert. Zusätzlich bietet der 3D-Biodruck die Flexibilität verschiedene Zelltypen und deren Anordnung im Gewebe gezielt zu steuern (36). Dadurch können verschiedene pathologische Zustände, zum Beispiel Verletzungen und Schäden, präzise nachgebildet und deren Auswirkungen auf die Zellfunktion beobachtet werden. Dies ist besonders wertvoll für das Verständnis neurodegenerativer und komplexer Erkrankungen.
Beispielsweise konnte durch den Einsatz von 3D-Biodruck ein durchblutetes Neuroblastom-Tumormodell auf einem Chip entwickelt werden, welches als Plattform zur Untersuchung der Bildung von Blutgefäßen im Tumor und der Tumorausbreitung, sowie für die Testung von Arzneimitteln genutzt werden kann (37).
Computerprogramme/KI
Künstliche Intelligenz (KI) und Computerprogramme spielen eine zunehmend wichtige Rolle in der Hirnforschung. Diese Technologien ermöglichen es, komplexe Daten zu analysieren, Muster zu erkennen und neue Erkenntnisse über das menschliche Gehirn zu gewinnen. Durch die Verarbeitung von Informationen aus Bevölkerungs- und Patientenstudien optimieren mathematische Modelle die Diagnostik von Krankheiten und liefern wertvolle Einblicke in spezifische Erkrankungen sowie potenzielle Therapien.
Ein bedeutender Anwendungsbereich von KI in der Hirnforschung ist die Analyse bildgebender Verfahren wie MRT- und CT-Scans (38). KI-Algorithmen können Bilder schnell und präzise auswerten, um Veränderungen in der Gehirnstruktur oder -funktion zu identifizieren. Dies ermöglicht eine frühzeitige Erkennung von Erkrankungen wie Alzheimer, Schlaganfällen oder Tumoren.
Zusätzlich wird KI eingesetzt, um große Datenmengen aus klinischen Studien auszuwerten. Mit Hilfe von maschinellem Lernen können Zusammenhänge zwischen genetischen Faktoren, Lebensstil und dem Auftreten von Hirnerkrankungen entdeckt werden, was zur Entwicklung personalisierter Behandlungsansätze beitragen kann (39).
Ein weiterer wichtiger Aspekt ist die Simulation von Gehirnaktivitäten. Computerprogramme können neuronale Netzwerke nachbilden und so das Verhalten von Nervenzellen sowie deren Interaktionen untersuchen. Diese Modelle tragen dazu bei, das Verständnis von Lern- und Gedächtnisprozessen zu vertiefen und die Auswirkungen von Therapien zu testen. Durch die Kombination von KI mit Hirn-Organoiden können sogar molekulare und zelluläre Aspekte von Lernen und Gedächtnis sowie kognitive Fähigkeiten nachgebildet und erforscht werden. Dies bildet den zentralen Ansatz eines innovativen Forschungsbereichs, der als „Organoide Intelligenz“ bekannt ist (40).
In der Toxikologie können Computerprogramme und KI zudem eingesetzt werden, um die Auswirkungen von Chemikalien auf das menschliche Gehirn und andere Organe zu untersuchen (41,42). Mit KI-gestützten Modellen kann vorhergesagt werden, wie bestimmte Substanzen Nervenzellen schädigen oder die Gehirnfunktion beeinträchtigen können. Dadurch können potenziell gefährliche Stoffe schneller identifiziert und deren Sicherheitsprofile besser bewertet werden.
In einer Studie wurde KI zum Beispiel angewendet, um bestimmte Muster in Proteinen im Blut von Menschen mit Autismus-Spektrum-Störungen zu erkennen. Durch diese Analyse konnten spezifische Biomarker identifiziert werden, die mit Autismus in Verbindung stehen, was die Diagnose und das Verständnis der Störung verbessern kann (43). In einer anderen Untersuchung kamen KI-Modelle zum Einsatz, um große Mengen an Bild- und Patientendaten zu analysieren, was eine frühzeitige Erkennung von Alzheimer ermöglichte (44). Eine frühzeitige Erkennung der Krankheit kann entscheidend sein, da dadurch eine schnellere Intervention ermöglicht werden kann.
Fazit
Der Umstieg auf tierversuchsfreie Methoden in der Hirnforschung ist ein wichtiger und notwendiger Schritt, um den wissenschaftlichen Fortschritt weiter voranzutreiben. Durch den Einsatz humanbasierter Technologien und Modelle wird nicht nur die Relevanz der Forschung für den Menschen erhöht, sondern auch die Möglichkeit geschaffen, präzisere und effektivere Behandlungsmethoden für neurologische Erkrankungen zu entwickeln, ohne dass Mensch oder Tier dabei zu Schaden kommen muss.
16.12.2024
Leyla Fox, Neurowissenschaftlerin
Literatur
- Homberg J.R. et al. The continued need for animals to advance brain research. Neuron 2021; 109(15):2374–2379
- Neumann, G. Wissenschaftliche Argumente gegen Tierversuche. Ärzte gegen Tierversuche, 02.08.2023 (abgerufen am 05.11.2024)
- Sun D. et al. Why 90% of clinical drug development fails and how to improve it? Acta Pharmaceutica Sinica B 2022; 12(7):3049–3062
- Biomedtracker. Clinical development success rates 2011-2020, Biomedtracker, 2020
- Biomedtracker. Clinical Development Success Rates 2014-2023, Biomedtracker, 2024
- Spencer S.J. et al. Food for thought: how nutrition impacts cognition and emotion. npj Science of Food 2017; 1(1):7
- Puri S. et al. Nutrition and cognitive health: A life course approach. Frontiers in Public Health 2023; 11
- Gomes Gonçalves N. et al. Association Between Consumption of Ultraprocessed Foods and Cognitive Decline. JAMA Neurology 2023; 80(2):142–150
- Shen C. et al. Associations of Social Isolation and Loneliness With Later Dementia. Neurology 2022; 99(2):e164–e175
- Kutter E.F. et al. Neuronal codes for arithmetic rule processing in the human brain. Current Biology 2022; 32(6):1275-1284.e4
- Smirnova L. et al. Blood extracellular vesicles carrying brain-specific mRNAs are potential biomarkers for detecting gene expression changes in the female brain. Molecular Psychiatry 2024; 29(4):962–973
- Grubisha M.J. et al. Investigating Post-translational Modifications in Neuropsychiatric Disease: The Next Frontier in Human Post-mortem Brain Research. Frontiers in Molecular Neuroscience 2021; 14
- De Picker L.J. et al. Immune environment of the brain in schizophrenia and during the psychotic episode: A human post-mortem study. Brain, Behavior, and Immunity 2021; 97:319–327
- Muñoz-Gutiérrez P.A. et al. Localization of Active Brain Sources From EEG Signals Using Empirical Mode Decomposition: A Comparative Study. Frontiers in Integrative Neuroscience 2018; 12
- Casson A.J. Wearable EEG and beyond. Biomedical Engineering Letters 2019; 9(1):53–71
- Liebherr M. et al. EEG and behavioral correlates of attentional processing while walking and navigating naturalistic environments. Scientific Reports 2021; 11(1):22325
- Yen C. et al. Exploring the Frontiers of Neuroimaging: A Review of Recent Advances in Understanding Brain Functioning and Disorders. Life 2023; 13(7):1472
- Boutet A. et al. Predicting optimal deep brain stimulation parameters for Parkinson’s disease using functional MRI and machine learning. Nature Communications 2021; 12(1):3043
- Tao Y. et al. Neural Subtype Specification from Human Pluripotent Stem Cells. Cell Stem Cell 2016; 19(5):573–586
- Maldonado-Soto A.R. et al. Stem Cells in the Nervous System. American journal of physical medicine & rehabilitation / Association of Academic Physiatrists 2014; 93(11 Suppl. 3):132–S144
- Klima S. et al. Examination of microcystin neurotoxicity using central and peripheral human neurons. ALTEX - Alternatives to animal experimentation 2021; 38(1):73–81
- Loser D. et al. Human neuronal signaling and communication assays to assess functional neurotoxicity. Archives of Toxicology 2021; 95(1):229–252
- Sarasola L.I. et al. The ADORA1 mutation linked to early-onset Parkinson’s disease alters adenosine A1-A2A receptor heteromer formation and function. Biomedicine & Pharmacotherapy 2022; 156:113896
- Brown A.-L. et al. TDP-43 loss and ALS-risk SNPs drive mis-splicing and depletion of UNC13A. Nature 2022; 603(7899):131–137
- Shou Y. et al. The Application of Brain Organoids: From Neuronal Development to Neurological Diseases. Frontiers in Cell and Developmental Biology 2020; 8
- Zhou J.-Q. et al. Brain organoids are new tool for drug screening of neurological diseases. Neural Regeneration Research 2023; 18(9):1884
- Modafferi S. et al. Gene–Environment Interactions in Developmental Neurotoxicity: a Case Study of Synergy between Chlorpyrifos and CHD8 Knockout in Human BrainSpheres. Environmental Health Perspectives 2021; 129(7):077001
- Rosety I. et al. Impaired neuron differentiation in GBA-associated Parkinson’s disease is linked to cell cycle defects in organoids. npj Parkinson’s Disease 2023; 9(1):1–16
- Fang Y. et al. Three-Dimensional Cell Cultures in Drug Discovery and Development. SLAS Discovery 2017; 22(5):456–472
- Botti G. et al. Organoid biobanks as a new tool for pre-clinical validation of candidate drug efficacy and safety. International Journal of Physiology, Pathophysiology and Pharmacology 2021; 13(1):17–21
- Lee S.H. et al. Advances in dynamic microphysiological organ-on-a-chip: Design principle and its biomedical application. Journal of Industrial and Engineering Chemistry 2019; 71:65–77
- Park S.E. et al. Organoids-on-a-chip. Science 2019; 364(6444):960–965
- Li M. et al. Blood–brain barrier microfluidic chips and their applications. Organs-on-a-Chip 2023; 5:100027
- Zeng Y.-L. et al. On-chip modeling of physiological and pathological blood-brain barrier microenvironment for studying glial responses to neuroinflammation. Nano Today 2023; 52:101947
- Trapecar M. et al. Human physiomimetic model integrating microphysiological systems of the gut, liver, and brain for studies of neurodegenerative diseases. Science Advances 2021; 7(5):eabd1707
- de la Vega L. et al. 3D bioprinting models of neural tissues: The current state of the field and future directions. Brain Research Bulletin 2019; 150:240–249
- Scarian E. et al. Patients’ Stem Cells Differentiation in a 3D Environment as a Promising Experimental Tool for the Study of Amyotrophic Lateral Sclerosis. International Journal of Molecular Sciences 2022; 23(10):5344
- Monsour R. et al. Neuroimaging in the Era of Artificial Intelligence: Current Applications. Federal Practitioner 2022; 39(1):14-20
- Rudroff T. Artificial Intelligence as a Replacement for Animal Experiments in Neurology: Potential, Progress, and Challenges. Neurology International 2024; 16(4):805–820
- Smirnova L. et al. Organoid intelligence (OI): the new frontier in biocomputing and intelligence-in-a-dish. Frontiers in Science 2023; 1
- Alam El Din D.-M. et al. Organoid intelligence for developmental neurotoxicity testing. Frontiers in Cellular Neuroscience 2024; 18
- Furxhi I. et al. Predicting In Vitro Neurotoxicity Induced by Nanoparticles Using Machine Learning. International Journal of Molecular Sciences 2020; 21(15):5280
- Hewitson L. et al. Blood biomarker discovery for autism spectrum disorder: A proteomic analysis. PLOS ONE 2021; 16(2):e0246581
- Kavitha C. et al. Early-Stage Alzheimer’s Disease Prediction Using Machine Learning Models. Frontiers in Public Health 2022; 10
