Personalisierte Krebstherapie
Auch wenn die überwiegend tierexperimentell ausgerichtete Forschung bei vielen Krebserkrankungen nach wie vor auf der Stelle tritt, gibt es neben oder zusätzlich zur operativen Entfernung des Tumors und der Bestrahlung eine Reihe von Medikamenten zur Behandlung von Krebs. Da sich die einzelnen Patienten und ihre individuellen Erkrankungen jedoch stark voneinander unterscheiden – ein Umstand, der in der tierexperimentellen Forschung keine Berücksichtigung findet - ist es notwendig, den für den einzelnen Patienten am besten geeigneten Wirkstoff auszuwählen. Gerade in der Krebstherapie bietet diese personalisierte Medizin Vorteile, da sie berücksichtigt, dass Menschen Individuen sind und ihre Tumorerkrankungen auf individuellen Veränderungen beruhen.
Dieser Beitrag zeigt, wie Methoden aus der modernen tierversuchsfreien Krebsforschung nicht nur die Entwicklung neuer Wirkstoffe vorantreiben, sondern auch eine für den jeweiligen Patienten maßgeschneiderte Therapie ermöglichen.
Vereinfachte Modelle spiegeln die Erkrankung nicht wider
Die tierexperimentell ausgerichtete Krebsforschung verwendet sogenannte Tiermodelle, die sich in vielfältiger Weise von den betroffenen Patienten unterscheiden. So werden den Tieren zur Tumorinduktion häufig Krebszellen aus Zelllinien injiziert, die bereits seit Jahren oder Jahrzehnten im Labor gezüchtet werden und sich dadurch erheblich von den in Patienten wachsenden Tumoren unterscheiden. Diese Zellen werden zumeist in Mäuse implantiert, die unter einem geschwächten Immunsystem leiden. Oft werden – unabhängig von der Lokalisation des ursprünglichen Tumors - die Zellen unter die Haut der Tiere injiziert, da so das Tumorwachstum von Außen einfach sicht- und messbar ist. Somit unterscheidet sich die Umgebung des Tumors in sogenannten Tiermodellen ganz wesentlich von der im Patienten: Sie enthält Zellen, Eiweiß- und Botenstoffe der Maus, entspricht nicht der Umgebung des Organs in dem der Tumor ursprünglich wuchs und verfügt nur über eine eingeschränkte Immunantwort (1).
Zudem werden die „Tiermodelle“ stark vereinfacht und standardisiert. So werden einzelne Zelllinien verwendet, die die Komplexität des Tumors, dessen Zellen sich stark voneinander unterscheiden können (2), nicht widerspiegeln und in gesunde, junge und zumeist männliche Mäuse genetisch einheitlicher Inzuchtstämme injiziert. Dies geschieht in dem beinahe verzweifelten Versuch, mit den an Tieren durchgeführten Versuchen doch noch vermeintlich sinnvolle Daten zu gewinnen, indem sich an den besonders einheitlichen Tieren möglichst kleine Effekte messen lassen. Doch dieses Vorgehen spiegelt in keiner Weise die Diversität von Krebspatienten und die Komplexität ihrer Erkrankungen wider.
Unterschiede zwischen Patienten und Tumoren
In den onkologischen Praxen kommen Patienten beider Geschlechter und unterschiedlicher Altersgruppen vor und die Patienten unterscheiden sich genetisch stark voneinander, weisen unterschiedliche Vor- und Begleiterkrankungen auf, die Krebserkrankung befindet sich in verschiedenen Stadien und ist bereits mit unterschiedlichen Therapien behandelt worden. Selbst wenn bei zwei Patienten ein und dasselbe Organ von Krebs befallen ist, unterscheiden sich die Tumorzellen von Patient zu Patient wesentlich voneinander und selbst innerhalb eines Tumors differieren die Zellen erheblich (2). Zudem verändert sich der Tumor auch im Laufe der Zeit und eine Therapie, die zunächst gut anschlägt, indem sie einen Teil der Krebszellen abtötet, kann im späteren Verlauf der Behandlung wirkungslos werden.
Dass sich Tumore unterscheiden können und unterschiedliche Therapien erfordern können, ist für Brustkrebs wohl bekannt. Ein Teil der Mammakarzinome weist auf der Oberfläche der Krebszellen Hormonrezeptoren auf, die den Tumor auf Hormone reagieren lassen. Ein solcher Rezeptor ist beispielsweise der Östrogen-Rezeptor, an welchen das weibliche Hormon andocken und das Wachstum des Tumors anregen kann. Für einen solchen Tumor können Antihormontherapien eingesetzt werden, die ein Andocken des Östrogens an den Tumor verhindern oder die Produktion des Östrogens unterbinden (3). Frauen deren Tumor den Östrogenrezeptor trägt können durch die Einnahme von Antihormontherapien ihre Prognose wesentlich verbessern, während diese Therapieform für andere Patientinnen nutzlos wäre. Es wird also deutlich, dass die Auswahl einer passenden Therapie auf den Eigenschaften der Tumorzellen des jeweiligen Patienten beruhen sollte.
Einige solcher Tumoreigenschaften werden bereits in den sogenannten S3-Leitlinien berücksichtigt. Bei diesen Leitlinien handelt es sich um von Experten anhand ihrer Erfahrungen zusammengestellte Dokumente, die Empfehlungen für die Diagnostik und Therapie enthalten. Somit werden viele Tumore bereits heute auf das Vorhandensein einzelner Oberflächenproteine überprüft. Neben dem bereits genannten Östrogen-Rezeptor wird auch der Humane Epidermale Rezeptor 2 (HER2) bei Brustkrebs routinemäßig untersucht. Bei HER2 handelt es sich um einen Rezeptor, der die Krebszellen zum Wachstum anregen kann und somit zu einem aggressiveren Tumor führt. Um dies zu verhindern, können Antikörper eingesetzt werden, die an HER2 binden und den Rezeptor blockieren (4).
Methoden die die Unterschiede berücksichtigen
Einzelne Biomarker oder „Sets“ von mehreren Biomarkern werden also bereits routinemäßig analysiert, um die Auswahl einer möglichst wirksamen Therapie zu ermöglichen. Neben den bekannten Rezeptoren, die bereits in die S3-Leitlinien zur Diagnostik und Therapie verschiedener Krebserkrankungen aufgenommen wurden, gibt es jedoch weitere Merkmale der Tumorzellen, die bei der Auswahl einer vielversprechenden Therapie eine Rolle spielen könn(t)en. Wie können solche Faktoren, die den Tumor beispielsweise besonders empfänglich oder aber resistent für eine bestimmte Therapie machen können, bei einer Therapieentscheidung berücksichtigt werden?
Es gibt eine Reihe von neueren Technologien aus der tierversuchsfreien Krebsforschung, welche eine umfassendere Analyse des jeweiligen patienteneigenen Tumors erlauben und mit denen patientenspezifische Therapieempfehlungen abgeleitet werden können.
Omics-Technologien
Bei den eingangs genannte Hormonrezeptoren auf der Krebszelle handelt es sich um Proteine, also Eiweißstoffe, die von der Krebszelle gebildet und an der Zelloberfläche präsentiert werden. Sie können zum Beispiel in Gewebeschnitten mit Farbstoff-markierten gegen den jeweiligen Rezeptor gerichteten Antikörpern nachgewiesen werden. Während dieses Verfahren für einzelne Oberflächenproteine oder eine kleinere Anzahl solcher sogenannter Biomarker zweckdienlich ist, stößt es schnell an seine Grenzen, wenn die Eigenschaften des Tumors umfassender und unter Berücksichtigung seltenerer Biomarker oder Mutationen untersucht werden sollen.
Hier bieten die sogenannten Omics-Technologien eine Möglichkeit, eine Vielzahl von Informationen über die molekularen Eigenschaften des Tumors zu erhalten (5). So macht man sich zunutze, dass die genetischen Informationen zur Herstellung der die Eigenschaften des Tumors beeinflussenden Proteine im Genom der Tumorzellen vorliegen. Eine Sequenzierung der in den Zellen enthaltenen DNA ergibt somit Aufschluss über vorhandene Zelloberflächenrezeptoren, die wegweisend in der Therapieentscheidung sein können. Zudem gibt sie Informationen über Prozesse, die die Zellen resistent gegenüber bestimmten Wirkstoffen machen können. Auch können durch die Genomanalyse genetische Mutationen, die für die Entstehung und das Fortschreiten des Krebses verantwortlich sind, identifiziert werden. So können Ärzte gezieltere Therapien einsetzen, die auf diese spezifischen Mutationen abzielen, wie zum Beispiel zielgerichtete Therapien und Immuntherapien.
Die Proteomik untersucht die Gesamtheit der Proteine in einer Zelle oder einem Gewebe. Sie erlaubt die Identifizierung von spezifischen Proteinen, die in Krebszellen exprimiert werden und potenzielle therapeutische Ziele darstellen könnten (6). Durch die Analyse von Proteininteraktionen können auch Wechselwirkungen zwischen verschiedenen Signalwegen entdeckt werden, die zur Krebsentwicklung beitragen.
Auch die sogenannte Metabolomik kann zur Auswahl geeigneter Therapien verwendet werden. Sie analysiert die Stoffwechselprodukte (Metabolite) einer Zelle oder eines Gewebes. Veränderte Stoffwechselwege sind ein charakteristisches Merkmal von Krebszellen. Durch die Untersuchung des Metaboloms können Hinweise auf spezifische Stoffwechselwege erhalten werden, die durch Medikamente beeinflusst werden könnten (7).
Die verschiedenen Omics-Technologien ermöglichen es somit, ein umfassendes Bild des individuellen Tumors und seiner biologischen Eigenschaften zu erhalten. Auf dieser Grundlage können die für den einzelnen Patienten am besten geeigneten Therapien ausgewählt werden (8).
Flüssigbiopsien
Die herkömmlichen Omics-Technologien erfordern Tumorzellen, welche üblicherweise aus Biopsien des Tumors oder dem resezierten Tumor selbst gewonnen werden. Da auch im Blut der Patienten Tumorbestandteile und die aus Tumorzellen stammende DNA vorhanden sind, ist es auch möglich, das benötigte Material aus einer Blutprobe zu gewinnen, was als Liquid Biopsy (deutsch: Flüssigbiopsie) bezeichnet wird. So lassen sich beispielsweise Mutationen der DNA im Tumor nachweisen und anhand dieser Information geeignete Medikamente auswählen. Auch ermöglicht eine Liquid Biopsy die Untersuchung der Tumorheterogenität. Da verschiedene Bereiche eines Tumors unterschiedliche genetische Mutationen aufweisen können, ist es möglich, dass eine Gewebebiopsie nicht das gesamte Tumorprofil erfasst. Hier kann eine Liquid Biopsy zusätzliche genetische Informationen liefern, die den gesamten Tumor und möglicherweise vorhandene Metastasen berücksichtigen (9).
Das Verfahren ermöglicht ein Screening zur Früherkennung, die Erkennung von Rezidiven, eine Abschätzung des Metastasierungsrisikos sowie die Identifizierung therapeutischer Zielstrukturen und daraus resultierende Therapieempfehlungen (10). Zudem ist die Liquid Biopsy patientenfreundlich, da lediglich eine Blutprobe nötig ist und auf eine invasive Biopsie verzichtet werden kann. Es wird auch daran geforscht, ob sich sogar Speichel und Urin für die Untersuchung auf Tumor-spezifisches Material eignen (10).
Zell-Systeme
Eine Limitierung der Omics-Technologien ist, dass nur bereits bekannte Biomarker (auf Proteinebene oder anhand ihrer DNA) identifiziert werden können und nur veränderte Stoffwechselvorgänge berücksichtigt werden können, die bereits bekannt sind. Anders ausgedrückt, es kann nur gefunden werden, wonach man gezielt sucht und was bereits mechanistisch verstanden ist. Hier kann es sinnvoll sein, eine noch umfassendere Untersuchung der Zellen durchzuführen. Anstatt Proteine auf der Zelloberfläche nachzuweisen, oder auf die Anwesenheit solcher Proteine auf DNA-Ebene rückzuschließen, ist der direkteste Zugang zu Informationen über das Ansprechen eines Tumors auf verschiedene Arzneimittel die direkte Untersuchung der Wirksamkeit an Zellen des Tumors (11).
Dazu werden beispielsweise Proben aus dem Tumor entnommen oder Material aus entfernten Tumoren verwendet. Aus diesen Geweben lassen sich Organoide, also kleine 3D-Zellkulturen, herstellen, die zum Screening möglicher Wirkstoffe eingesetzt werden können. Dies ermöglicht in der tierversuchsfreien Krebsforschung die Identifizierung neuer Wirkstoffe, indem neue Substanzen mit den Organoiden in Kontakt gebracht werden und untersucht wird, ob sie das Wachstum oder Überleben der Organoide beeinflussen (12).
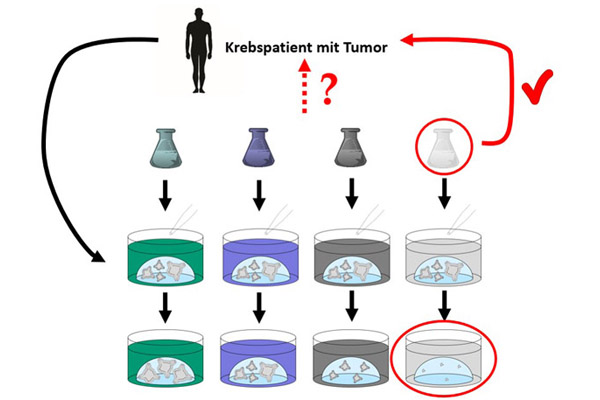
Aus patienteneigenen Tumorproben werden Organoide gezüchtet, mit denen der Wirkstoff ausgewählt werden kann, der die Krebszellen des betreffenden Patienten am effektivsten bekämpft (Bildquelle: Ärzte gegen Tierversuche).
Werden die Organoide aus Zellen eines Tumors eines bestimmten Patienten gewonnen, nennt man sie Patienten-eigene Organoide (englisch: Patient-derived organoids, PDO). Diese Organoide behalten Eigenschaften des ursprünglichen Tumors bei, die Oberflächenproteine auf den Zellen entsprechen denen im ursprünglichen Tumor und mögliche Resistenzen des Tumors gegen bestimmte Wirkstoffe bleiben auch im Organoid erhalten (13). So können Organoide im Labor aus Proben des Tumors eines individuellen Patienten gezüchtet werden und dann mit verschiedenen möglichen Medikamenten behandelt werden, um das Medikament zu identifizieren, welches die Tumor-Organoide – und somit auch den Tumor des Patienten – am effektivsten abtötet oder im Wachstum behindert.
Diese Verwendung von Tumor-Material bietet den unmittelbaren Zugang zu Informationen über ein mögliches Therapieansprechen, ohne dass die zugrundeliegenden genetischen Veränderungen bekannt sein müssen.
Irrwege der translationalen Medizin
Auch wenn mit Patienten-eigenen Organoiden ideale Modelle zur Untersuchung individueller Tumore im Labor zur Verfügung stehen, scheint ein Teil der Krebsforscher so verfangen in ihrem Glauben an sogenannte Tiermodelle, dass sie auch im Bereich der personalisierten Medizin auf sie zurückgreifen.
PDX-Modell
So werden Patienten-spezifische Tumor-Organoide im sogenannten PDX-Modell (englisch: patient-derived xenograft) in Mäuse eingepflanzt (14). Hierzu werden immundefiziente Mäuse eingesetzt, das heißt, Tiere mit geschwächtem Abwehrsystem. Das bedeutet, dass das Immunsystem, welches bei der körpereigenen Abwehr gegen den Tumor eine entscheidende Rolle spielt, in dem experimentellen Setup keinerlei Berücksichtigung findet. Auch befindet sich der Tumor in einer murinen (= Mäuse-) Umgebung und häufig wachsen die Tumore in der Maus nicht wie gewünscht heran. Zudem dauert die „Etablierung“ von solchen sogenannten Xenograft-Modellen Zeit, die viele Patienten nicht haben. Und selbst wenn der Patient noch leben sollte, wenn die Mäuse, in denen sein Tumor wächst, so weit sind, dass sie in Tierversuchen eingesetzt werden können, so kann sich der Tumor bis dahin ganz wesentlich verändert haben – sowohl im Patienten, als auch in der Maus (14). Somit bleibt das ernüchternde Fazit, dass hier Mäuse als „Anzuchtgefäße“ für Tumore missbraucht werden, wobei unter der Bezeichnung „Personalisierte Medizin“ ein direkter Nutzen für den Menschen vorgegaukelt wird, der so nicht existiert.
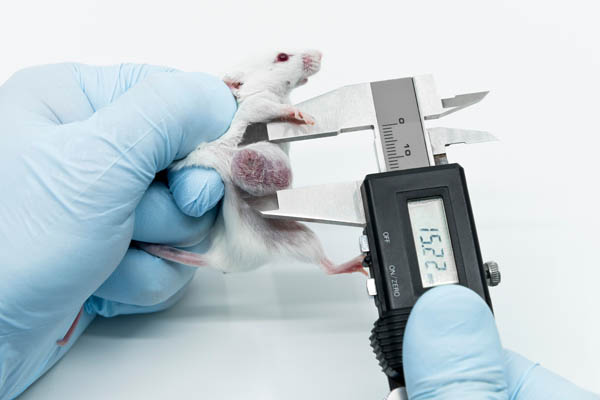
Mäuse werden als „Anzuchtgefäße“ für Tumore missbraucht.
Testung an Hühnerembryonen
Ein weiterer Auswuchs der tierexperimentell-ausgerichteten Krebsforschung ist die Verwendung von Hühnerembryonen in der personalisierten Medizin (15). Dabei wird in die Schale befruchteter Hühnereier eine Öffnung geschnitten. Dann werden Krebszellen oder Tumorstückchen auf der Membran des Hühnerembryos ausgesät. Die Eier werden dann weiter bebrütet, wodurch der Tumor wächst und sich Tumorzellen auch in den Hühnerembryo ausbreiten. Ein beträchtlicher Teil der Embryonen stirbt während der Versuche, der Rest wird wenige Tage vor dem Schlupf getötet, der Tumor „geerntet“ und untersucht (15,16). Besonders perfide ist, dass Versuche an Hühnerembryonen in Deutschland keiner Genehmigung bedürfen, da durch die Richtlinie 2010/63/EU zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere nur Embryonen von Säugetieren, nicht jedoch Vogelembryonen berücksichtigt und geschützt werden (17). Somit werden die grausamen Versuche an Hühnerembryonen im Sinne der 3R („Replace, Reduce, Refine“) sogar als „Alternative“ zu Tierversuchen angesehen (16).
Warum nur vollständig humane Modelle zielführend sind
Der Erfolg bei der Entwicklung neuer Medikamente ist mit einer Versagensquote von durchschnittlich über 92 % ohnehin ernüchternd (18). Bei Krebsmedikamenten sind es sogar nahezu 95 % der potenziellen neuen Behandlungsmethoden, die im „Tiermodell“ als wirksam und sicher getestet wurden, dann aber in den klinischen Studien am Menschen scheitern und nicht auf den Markt gelangen (18).
Auch die Medikamente, die den Patienten erreichen, bieten häufig lediglich eine überschaubare Verbesserung hinsichtlich Überlebenszeit und Lebensqualität (19). Einer der Hauptgründe dafür ist die fehlende Translation von der Präklinik in die Klinik. Aufgrund der Unterschiede zwischen Tier und Mensch können Wirkstoffe, die im Tierversuch eine hohe Wirksamkeit und gute Verträglichkeit zeigen, beim Menschen keine Wirkung oder schwere Nebenwirkungen aufweisen (20). Dass die tierversuchsbasierte Forschung nicht zielführend ist, erkennen auch immer mehr Pharmafirmen (21). Gerade in der Krebstherapie bietet eine personalisierte Medizin Vorteile, da sie berücksichtigt, dass Menschen Individuen sind und ihre Tumorerkrankungen auf individuellen Veränderungen beruhen. Der bereits von Patient zu Patient unterschiedliche Behandlungserfolg zeigt auch, dass die tierexperimentelle Forschung nicht funktionieren kann.
Möglichkeiten für Onkologen und Patienten
Die personalisierten Methoden finden in der Krebsforschung immer mehr Verwendung und werden darüber hinaus auch für behandelnde Ärzte und ihre Patienten zunehmend verfügbar. Sie ermöglichen so eine personalisierte, auf den jeweiligen Patienten und seine individuelle Erkrankung optimal abgestimmte Therapieentscheidung. So kann mit Hilfe von Omics-Technologien oder Organoiden die am besten wirksame Therapie identifiziert werden, ohne dass zunächst nach einem „Versuch und Irrtum“ Verfahren möglicherweise unwirksame und mit Nebenwirkungen verbundene Therapien durchgeführt werden, die dem Patienten nicht nutzen aber wertvolle Zeit kosten.
Um Patienten und ihren behandelnden Ärzten einen Zugang dazu zu verschaffen, bieten einige Firmen die Untersuchungen als Dienstleistung an. Dazu werden Proben, also Tumorgewebe oder Blutproben, an die Firmen versandt, wo dann entsprechende Untersuchungen durchgeführt werden. Aus den Ergebnissen werden maßgeschneiderte Therapieempfehlungen abgeleitet und dem behandelnden Onkologen in einem Bericht zur Verfügung gestellt. Teilweise werden dabei neben Standardmedikamenten auch derzeit aktive klinische Studien berücksichtigt, welche Patienten, die davon profitieren könnten, empfohlen werden. Einige Firmen, die diese Methoden anbieten, geben wir im Folgenden an (siehe Kasten).
Ein Wegweiser zur maßgeschneiderten Therapie
Im Folgenden werden Möglichkeiten aufgezeigt, die Onkologen und ihren Patienten einen einfachen Zugang zu einer umfassenden Tumordiagnostik und daraus resultierenden personalisierten Therapieempfehlungen ermöglichen. Die Ausführungen erheben keinen Anspruch auf Vollständigkeit und sollen lediglich über die Bandbreite an Möglichkeiten informieren sowie eine einfache Kontaktaufnahme ermöglichen.
Omics-Technologien
Omics-basierte personalisierte Therapieentscheidung bieten unter anderem die Zenten für Personalisierte Medizin (ZPM) an. Omics-Analysen werden insbesondere durchgeführt, wenn die Leitlinientherapie ausgeschöpft ist oder keinen Erfolg verspricht, sowie bei sehr seltenen Tumorerkrankungen. Die umfassende Biomarker-Suche öffnet die Möglichkeit, doch noch eine erfolgversprechende Therapie für den Patienten zu finden. Dabei werden vor allem genetische Analysen von fixiertem Tumorgewebe mittels Next Generation Sequencing (NGS) und immunhistochemische Färbemethoden für funktionale Analysen angewendet. Aber auch Analysen des Tumorstoffwechsels (Metabolismus) oder der Tumorproteine sind möglich. Bei den durch interdisziplinäre Molekulare Tumorboards erstellten Therapieempfehlungen werden bei passendem molekularem Profil auch Medikamente außerhalb der eigentlichen Zulassung (Off-Label), sowie individualisierte Therapieansätze wie zellbasierte Therapien und Immuntherapien berücksichtigt. ZPMs finden sich unter anderem in Heidelberg, Tübingen, Freiburg und Ulm. Weitere Zentren sind auf der Seite des Deutschen Netzwerk Personalisierte Medizin (DNPM) zu finden (22). Laut DNPM übernimmt die gesetzliche Krankenkasse die Kosten, wenn eine leitliniengerechte Therapie nicht (mehr) vorhanden oder nicht erfolgversprechend ist.
Auch die Firma Foundation Medicine (Roche) bietet verschiedene molekulare Tumorprofilings für unterschiedliche Tumorerkrankungen an (23). Der resultierende Bericht bietet Einblicke in das molekulare Tumorprofil sowie damit verbundene mögliche zielgerichtete Therapien, Immuntherapien und entsprechende klinische Studien. Zudem werden Gene, die mit einer möglichen Therapieresistenz verbunden sind, identifiziert, so dass den Patienten potenziell unwirksame Behandlungen erspart werden können. Laut Foundation Medicine ist eine Kostenerstattung durch die Krankenkassen nach Einzelfallentscheidung möglich.
Liquid Biopsy
Foundation Medicine ermöglicht auch die Analyse von Blutproben auf genomische Veränderungen in über 300 krebsrelevanten Genen. Dies ermöglicht eine Patienten-freundliche Diagnostik ohne Biopsie, eine Verlaufskontrolle, die Kontrolle auf Rezidive sowie Patienten-spezifische Therapieempfehlungen (23).
Patienten-spezifische Tumor-Organoide
Die Firma ASC Oncology bietet die Testung verschiedener Wirkstoffe mit Hilfe von aus Patienten-eignem Tumorgewebe gezüchteten Tumor-Organoiden an. Während der Tumor-OP oder Biopsie wird dafür ein kleines Stück des frisch entnommenen Tumorgewebes in ein Probenröhrchen gegeben und per Express-Kurier in das Labor gesendet. An den aus der Probe hergestellten Patienten-spezifischen Tumor-Modellen wird die Wirksamkeit verschiedener Medikamente überprüft. Dadurch werden auch mögliche unbekannte genetische Veränderungen berücksichtigt, ohne dass diese bekannt sein müssen. Die Testung berücksichtigt Zytostatika, zielgerichtete Therapien, Antikörper, Präparate im Off-Label-Use, aktuelle klinische Prüfpräparate sowie experimentelle, alternativmedizinische bzw. naturheilkundliche Medikamente als Einzel- oder Kombinationstherapie (24). Die Organoid-basierte Diagnostik gehört zu den individuellen Gesundheitsleistungen (IGeL), ein Antrag auf Kostenübernahme durch die Krankenkassen ist möglich, dafür stellt ASC Oncology Vordrucke zur Verfügung.
Personalisierte Medizin für weitere Erkrankungen
Nicht nur Krebs, auch viele weitere Erkrankungen unterscheiden sich teilweise stark von Patient zu Patient und auch hier gibt es personalisierte Ansätze aus der tierversuchsfreien Forschung.
Exemplarisch sei hier ein Beispiel beschrieben, dass zeigt, wie Patienten mit zystischer Fibrose (Mukoviszidose) davon profitieren können. Bei zystischer Fibrose liegt eine Veränderung des CFTR (von englisch: Cystic Fibrosis Transmembrane Conductance Regulator) vor. Dabei handelt es sich um ein Protein, das an Zelloberflächen einen Kanal ausbildet, durch den Salz die Zelle verlassen kann. Verschiedene Mutationen des CFTR-Gens führen dazu, dass sich bei zystischer Fibrose das Salz in den Zellen anreichert, wodurch die Umgebung der Zellen austrocknet und sich beispielsweise der Schleim in den Lungen verfestigt. Dabei kann das CFTR-Gen auf verschiedenste Weise verändert sein (hier sind bisher etwa 2.000 Mutationen bekannt), was die Auswahl einer für den jeweiligen Patienten geeigneten Therapie erschwert (25). Um dennoch eine geeignete Behandlung auswählen zu können, wurde ein Testverfahren mit Patienten-eigenen Darm-Organoiden entwickelt. Die Organoide werden mit verschiedenen möglichen Wirkstoffen behandelt. Dann wird eine Chemikalie zugegeben, welche bei Organoiden mit funktionalem CFTR zu einem Anschwellen der Zelle führt, nicht jedoch bei Organoiden mit defektem CFTR. So können die Wirkstoffe ausgewählt werden, die im Organoid-Modell die Funktion des CFTR wiederherstellen und diese dann zur Therapie des Patienten verwendet werden (26). Auf dem Microphysiological Systems (MPS) World Summit 2023 wurde darüber berichtet, wie das Verfahren erfolgreich eingesetzt wurde, um für eine Patientin mit einer seltenen Mutation, die in den S3–Richtlinien nicht berücksichtigt wird und für die entsprechend keine Therapieempfehlungen vorliegen, eine geeignete Therapie auszuwählen, die den Gesundheitszustand der Patientin dramatisch verbesserte (27).
Fazit
Die personalisierte Medizin ist ein Paradebespiel für die Leistungsfähigkeit tierversuchsfreier Methoden. Während Tierversuche an den Unterschieden zwischen Tier und Mensch scheitern, liefert die personalisierte Medizin nicht nur human-relevante Ergebnisse, sondern ermöglicht auch auf einzelne Patienten bezogene Aussagen. Das Potential der personalisierten Medizin erstreckt sich dabei von der Krebsforschung bis hin zur Klinik. In der Krebsforschung ermöglichen Patienten-eigene Organoide die Forschung an einem humanen Modell und gleichzeitig die Berücksichtigung Patienten-spezifischer Unterschiede bereits früh in der Medikamentenentwicklung.
Jenseits der Krebsforschung eröffnet die personalisierte Medizin auch vollkommen neue Möglichkeiten für Onkologen und ihre Patienten: Patienten-eigene Organoide oder DNA-Analysen ermöglichen eine fundierte und auf den jeweiligen Patienten und seine individuelle Krebserkrankung optimal abgestimmte Therapieauswahl. Dadurch kann der Patient die für ihn am besten wirksame Therapie erhalten und unnötige – weil nicht wirksame aber mit Nebenwirkungen verbundene - Therapien bleiben ihm erspart. Somit werden personalisierte Therapieentscheidungen zu wesentlichen Verbesserungen für Patienten und auch zu Einsparungen im Gesundheitssystem führen.
Aktualisiert am 08.03.2024
Dr. Johanna Walter
Quellen
- Johanna Walter. Krebs: Tierversuche und tierversuchsfreie Forschung. 2023
- Sun X. et al. Intra-tumor heterogeneity of cancer cells and its implications for cancer treatment. Acta Pharmacologica Sinica 2015; 36(10):1219–1227
- Deutsches Krebsforschungszentrum (DKFZ): Brustkrebs: Die Antihormontherapie (abgerufen am 15.08.2023)
- Ishii K. et al. Pertuzumab in the treatment of HER2-positive breast cancer: an evidence-based review of its safety, efficacy, and place in therapy. Core Evidence 2019; Volume 14:51–70
- Rossing M. et al. Whole genome sequencing of breast cancer. APMIS 2019; 127(5):303–315
- Su M. et al. Proteomics, Personalized Medicine and Cancer. Cancers 2021; 13(11):2512
- Jacob M. et al. Metabolomics toward personalized medicine. Mass Spectrometry Reviews 2019; 38(3):221–238
- Chen R. et al. Promise of personalized omics to precision medicine. WIREs Systems Biology and Medicine 2013; 5(1):73–82
- Hemenway G. et al. Clinical Utility of Liquid Biopsy to Identify Genomic Heterogeneity and Secondary Cancer Diagnoses: A Case Report. Case Reports in Oncology 2022; 15(1):78–85
- Lone S.N. et al. Liquid biopsy: a step closer to transform diagnosis, prognosis and future of cancer treatments. Molecular Cancer 2022; 21(1):79
- Yang H. et al. Patient-derived organoids: a promising model for personalized cancer treatment. Gastroenterology Report 2018; 6(4):243–245
- Kondo J. et al. Application of Cancer Organoid Model for Drug Screening and Personalized Therapy. Cells 2019; 8(5):470
- Abugomaa A. et al. Patient-derived organoid analysis of drug resistance in precision medicine: is there a value? Expert Review of Precision Medicine and Drug Development 2020; 5(1):1–5
- Harris A.L. et al. Patient-derived tumor xenograft models for melanoma drug discovery. Expert Opinion on Drug Discovery 2016; 11(9):895–906
- Chu P.-Y. et al. Applications of the Chick Chorioallantoic Membrane as an Alternative Model for Cancer Studies. Cells Tissues Organs 2022; 211(2):222–237
- Ranjan R.A. et al. The Chorioallantoic Membrane Xenograft Assay as a Reliable Model for Investigating the Biology of Breast Cancer. Cancers 2023; 15(6):1704
- Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere Text von Bedeutung für den EWR.
- Biotechnology Innovation Organization, Informa Pharma Intelligence & QLS Advisors, New Clinical Development Success Rates 2011-2020 Report
- Davis C. et al. Availability of evidence of benefits on overall survival and quality of life of cancer drugs approved by European Medicines Agency: retrospective cohort study of drug approvals 2009-13. BMJ 2017; doi: 10.1136/bmj.j4530:j4530
- Loewa A. et al. Human disease models in drug development. Nature Reviews Bioengineering 2023; doi: 10.1038/s44222-023-00063-3
- Frankfurter Rundschau vom 26.05.2023, Merck-Chefin spricht sich für Ausstieg aus Tierversuchen aus. 2023
- Zentren des Deutschen Netzwerks für Personalisierte Medizin DNPM (abgerufen am 15.08.2023)
- Foundation Medicine: Portfolioübersicht (abgerufen am 15.08.2023)
- ASC Oncology (abgerufen am 15.08.2023)
- Mukoviszidose e.V.: Die Ursache der Mukoviszidose (abgerufen am 15.08.2023)
- HUB ORGANOIDS: Forskolin-induced swelling assay (abgerufen am 15.08.2023)
- MPS WS Abstract Book. ALTEX Proceedings 2023; doi: 10.58847/ap.2301
