Brustkrebs: Tierversuche und tierversuchsfreie Forschung
Brustkrebs ist die weltweit am häufigsten diagnostizierte Krebserkrankung bei Frauen. Laut dem Zentrum für Krebsregisterdaten (ZfKD) wurde im Jahr 2022 in Deutschland bei 74.500 Frauen und 690 Männern Brustkrebs diagnostiziert. Im Laufe ihres Lebens wird jede achte Frau mit der Diagnose Brustkrebs konfrontiert (1). Obwohl die Behandlungsmöglichkeiten in den letzten Jahrzehnten erheblich verbessert wurden, bleibt Brustkrebs eine der häufigsten Todesursachen bei Frauen (2). Die komplexe Biologie der Krankheit und ihre verschiedenen Subtypen erschweren die Entwicklung neuer Behandlungsmöglichkeiten. Zudem wird nach wie vor überwiegend mit sogenannten Tiermodellen an neuen Therapien geforscht. Dieser Beitrag beleuchtet, warum Tierversuche in der Brustkrebsforschung nicht zielführend sind und welche modernen, auf den Menschen fokussierte Methoden besser geeignet sind.
Brustkrebs entsteht durch unkontrolliertes Zellwachstum in den Brustdrüsen und kann in benigne (gutartige) und maligne (bösartige) Tumore unterteilt werden. Maligne Tumore haben das Potenzial, sich über die Lymph- oder Blutbahnen im Körper auszubreiten und Metastasen zu bilden. Die Erforschung der Mechanismen, die zur Entstehung und Ausbreitung von Brustkrebs führen, ist entscheidend, um effektive Therapien zu entwickeln.
Verfügbare Behandlungsmöglichkeiten
Die Behandlung von Brustkrebs umfasst in der Regel Operation, Chemotherapie, Strahlentherapie, Hormontherapie und zielgerichtete Therapien sowie Kombinationen davon. Die Wahl der Therapie hängt vom Subtyp des Brustkrebses, seinem Stadium und den individuellen Charakteristika der Patientin ab.
- Operation: Dabei wird der Tumor chirurgisch entfernt. Je nach Ausdehnung kann dies eine Brust-erhaltende Operation oder eine Mastektomie sein.
- Chemotherapie: Diese Methode nutzt Medikamente, um Krebszellen im gesamten Körper abzutöten. Leider ist sie oft mit schweren Nebenwirkungen verbunden, da auch gesunde Zellen geschädigt werden.
- Strahlentherapie: Hierbei wird der Tumor mit hochenergetischer Strahlung behandelt, um das Wachstum der Krebszellen zu hemmen. So kann ein Tumor beispielsweise verkleinert werden, um ihn dann operativ zu entfernen.
- Hormontherapie: Für Tumore, deren Wachstum von Hormonen abhängt, stehen Therapien zur Verfügung, die die Wirkung der Hormone blockieren oder ihre Produktion reduzieren.
- Zielgerichtete Therapien: Diese relativ neuen Behandlungsansätze greifen spezifische Moleküle an, die für das Wachstum und die Ausbreitung von Krebszellen verantwortlich sind. Durch die zielgerichtete Wirkung können systemische Nebenwirkungen auf gesunde Zellen verringert werden (3).
Trotz dieser Vielzahl an Behandlungsformen besteht weiterhin ein erheblicher Bedarf an der Entwicklung neuer Therapien. Besonders bei fortgeschritteneren Krebserkrankungen, bei denen der Tumor bereits metastasiert hat, sinken die Überlebensraten deutlich. Hinzu kommen Herausforderungen wie die Entwicklung von Resistenzen gegenüber Medikamenten und die teils gravierenden Nebenwirkungen der bestehenden Behandlungsansätze.
Um neue und wirksamere Therapien zu entwickeln, verwenden viele Forscher nach wie vor Tierversuche.
Tierversuche
Wie in der Krebsforschung allgemein (4), leiden und sterben auch in der Brustkrebsforschung überwiegend Mäuse. Dies geschieht nicht etwa, weil sie dem Menschen besonders ähnlich sind, sondern weil sie klein sind und sich einfach und kostengünstig halten lassen. Zudem sind die Techniken zur genetischen Manipulation von Mäusen – bspw. um sie anfälliger für Krebs zu machen oder menschliche Gene einzufügen – im Vergleich zu anderen Tierarten weit fortgeschritten (5).
Da Mäuse und andere Nagetiere kaum an Krebs erkranken, müssen die Forscher Brustkrebs in den Tieren künstlich hervorrufen. Dazu wurden verschiedene Methoden entwickelt, die im Folgenden kurz beschrieben werden.
Induktion von Tumoren
Um Brusttumoren bei Mäusen zu erzeugen, werden ihnen verschiedene Chemikalien oder krebserregende Viren verabreicht (5). Ein Beispiel dafür ist die Chemikalie 7,12-Dimethylbenz(a)-anthracen (DMBA), die gezielt eingesetzt wird, um Brustkrebs bei Mäusen oder Ratten auszulösen. DMBA ist ein stark krebserregender Stoff, der DNA-Schäden verursacht. Den Tieren wird die Substanz in der Regel über 4 bis 6 Wochen einmal wöchentlich entweder mithilfe einer Schlundsonde oder durch eine Injektion in die Bauchhöhle verabreicht. Innerhalb von 150 – 200 Tagen entwickeln 30 bis 70 % der Mäuse Tumore der Brust, die zum Teil in die Lunge metastasieren (6).
Brustkrebs kann auch durch physikalische Methoden wie ionisierende Strahlung ausgelöst werden. So führt beispielsweise eine Ganzkörperbestrahlung mit Röntgen- oder Neutronenstrahlen bei Ratten zu Brustkrebs (5). Eine Bestrahlung mit einer Dosis von 2 Gray verursacht bei 22 % der Mäuse Brustkrebs; oft entwickeln die Tiere durch die Strahlung auch Eierstockkrebs (7).
Transplantation von Krebszellen
Die oben beschriebenen Methoden zur Induktion führen oft nur bei einem Teil der Tiere zu der Bildung der gewünschten Tumore. Zudem dauert es lange, bis sich Tumoren entwickeln, und die Zeitspanne kann stark variieren. Um schnellere und besser in eine Versuchsplanung integrierbare „Tiermodelle“ zu schaffen, wurden Methoden zur Transplantation von Krebszellen entwickelt.
Da Brustkrebs von den Brustdrüsen ausgeht, werden die Zellen bevorzugt direkt in diese Drüsen gespritzt und bilden dort Tumore. Diese Methode ist jedoch technisch schwierig und erlaubt nur die Übertragung einer geringen Menge an Zellen. Aus diesem Grund werden die Krebszellen häufig in das Fettgewebe der Brust injiziert. Eine weitere Methode ist die Injektion der Zellen unter die Haut, da sich die entstehenden Tumore dort gut von außen beobachten und vermessen lassen. Um gezielt Metastasen zu erzeugen, werden Brustkrebszellen dagegen in bestimmte Bereiche des Körpers injiziert. Beispielsweise führt eine Injektion in die Schwanzvene der Tiere zu Metastasen in der Lunge. Wenn die Zellen direkt ins Herz gespritzt werden, bilden sich Metastasen in den Knochen und im Gehirn (5).
Die Modelle, bei denen Brustkrebszellen injiziert werden, lassen sich je nach Herkunft der Zellen in Allotransplantate und Xenotransplantate unterteilen. Bei Allotransplantaten werden den Mäusen Krebszellen injiziert, die ebenfalls von Mäusen stammen. Diese Krebszellen stammen entweder aus spontan entstandenen Tumoren oder aus Tumoren, die künstlich hervorgerufen wurden (wie oben beschrieben). In diesen Fällen wächst also ein Tumor, der aus Mäusezellen besteht, in einem Mäusekörper heran. Dabei unterscheidet sich sowohl der Tumor selbst als auch der Organismus, in dem er wächst, deutlich von der Situation bei einem Menschen.
In dem Versuch, die menschliche Situation im Tier besser zu „modellieren“, werden auch menschliche Brustkrebszellen in Mäuse transplantiert. Dieses Verfahren führt zu einem sogenannten Xenotransplantat-Modell. Dabei kommen Mäuse mit einem stark eingeschränkten Immunsystem zum Einsatz, da ihr eigenes Immunsystem die menschlichen Krebszellen sonst abstoßen würde. Verwendet werden beispielsweise Nacktmäuse (ohne T-Zellen), NOD-SCID-Mäuse (ohne T- und B-Zellen) oder NSG-Mäuse (ohne T-, B-, natürliche Killerzellen und Makrophagen) (8).
In der Krebsforschung werden häufig Nacktmäuse mit defektem Immunsystem eingesetzt. Quelle: adobestock/Vasiliy-Koval.
In vielen Fällen werden Tumorzelllinien eingesetzt – das sind Zellen, die ursprünglich aus menschlichen Tumoren gewonnen wurden und seit Jahrzehnten im Labor kultiviert werden. Aufgrund der langen Kultivierung unter künstlichen Bedingungen haben sich diese Zelllinien jedoch verändert und unterscheiden sich in wichtigen Eigenschaften von den Tumoren, die in Patienten wachsen. Um dieses Problem zu umgehen, werden zunehmend sogenannte PDX-Modelle (Patienten-abgeleitete Xenotransplantate) genutzt. Dabei stammen die transplantierten Zellen direkt aus Tumorproben von Patienten. Trotzdem weisen auch PDX-Modelle den entscheidenden Nachteil auf, dass die Mikroumgebung, in der der Tumor wächst, nicht der Situation im menschlichen Körper entspricht. Außerdem ermöglicht das stark eingeschränkte Immunsystem der Tiere keine Untersuchung der Wechselwirkungen zwischen Tumor und Immunsystem oder der Effekte von Immuntherapien.
Dies trägt zur mangelnden Übertragbarkeit der Ergebnisse von Tierversuchen auf den Menschen bei. Daher gibt es Bestrebungen, die sogenannten Tiermodelle zu „humanisieren“, also menschenähnlicher zu gestalten. Dabei wird vor allem versucht, das Immunsystem der Tiere anzupassen bzw. durch einzelne Komponenten des menschlichen Immunsystems zu ersetzen. Dazu werden den Mäusen vor oder nach der Transplantation von Tumorzellen menschliche Immunzellen verabreicht – entweder in Form von peripheren Blutmonozyten (PBMCs) oder hämatopoetischen Stammzellen (HSCs). Allerdings können auch solche humanisierten Modelle nur Teile des menschlichen Immunsystems nachbilden. Zudem kann es bei der Verwendung bestimmter menschlicher Immunzellen zur sogenannten Graft-versus-Host-Erkrankung (GvHD) kommen. Dabei greifen die implantierten menschlichen Immunzellen die Zellen der Maus an, was die Lebensdauer der Tiere reduziert und damit den Untersuchungszeitraum verkürzt (9).
Genetisch veränderte „Mausmodelle“
Mit gentechnischen Methoden können bei Mäusen gezielt bestimmte Gene verändert werden, um Tumore entstehen zu lassen. Dabei können entweder Gene, die normalerweise das Tumorwachstum unterdrücken, ausgeschaltet werden, oder sogenannte Onkogene – das sind Gene, die die Entstehung von Tumoren fördern – in das Erbgut der Mäuse eingefügt werden.
Ein Beispiel dafür ist das Onkogen „polyomavirus middle T“ (PyMT). Wenn dieses Gen integriert wird, kommt es zu besonders aggressivem Tumorwachstum. Die betroffenen Mäuse entwickeln bereits im Alter von 4 bis 8 Wochen sichtbare Brusttumore, und bei 84 % bis 90 % der Mäuse bilden sich im Alter von 14 Wochen Metastasen in der Lunge (5).
Häufig werden auch menschliche Gene oder Genmutationen, die mit Brustkrebs in Verbindung stehen, in das Erbgut der Mäuse eingebracht, um die Erkrankung zu erforschen.
Weitere „Tiermodelle“
Neben Mäusen und Ratten werden auch weitere Tierarten wie Fadenwürmer, Fruchtfliegen, Zebrafische und Hühner in der Brustkrebsforschung eingesetzt (5). Der Hauptgrund dafür liegt in der schnelleren Durchführbarkeit von Experimenten und den geringeren Kosten. So haben Forscher beispielsweise Zellen von menschlichen Knochenmetastasen in Zebrafischembryonen injiziert, um das Metastasierungspotenzial dieser Zellen zu untersuchen (10).
Diese Tierarten unterscheiden sich jedoch noch stärker vom Menschen als Mäuse und Ratten, und viele ihrer Gene haben keine Entsprechung beim Menschen. Dadurch wird eine Übertragbarkeit der Ergebnisse auf den Menschen noch unwahrscheinlicher.
Auch größere Tiere wie Hunde und nicht-menschliche Primaten, bei denen Brustkrebs ähnlich wie beim Menschen spontan auftreten kann, sowie Schweine werden als „Modelle“ für Brustkrebs vorgeschlagen und untersucht (11–14). Hier geben die Forscher an, dass die höhere genetische Übereinstimmung und Körpergröße zu einer besseren Übertragbarkeit führen sollen. Sogar Katzen wurden in der Forschung als „Modelle“ für Brustkrebs herangezogen. Dabei wurden sowohl spontan entstandene Brusttumore als auch Tumore untersucht, die durch die Injektion von Tumorzellen in Katzen-Embryonen erzeugt wurden. Den Katzen wurden dazu bereits im Mutterleib aus einem in Katzen herangewachsenen Brusttumor gewonnene Zellen injiziert. Bei ihrer Geburt wiesen die Tiere Tumore auf, die nach 6 bis 10 Wochen metastasierten. Die Forscher glauben, mit diesem Modell metastasierende Brusttumore des Menschen nachbilden und untersuchen zu können (15).
Das Scheitern der tierversuchsbasierten Brustkrebsforschung
Tierversuche dienen vermeintlich dazu, Krankheitsmechanismen zu verstehen, Therapien zu entwickeln sowie die Sicherheit und Wirksamkeit neuer Therapien zu testen, bevor sie in klinischen Studien am Menschen erprobt werden. Doch gerade in diesen Studien am Menschen wird die mangelnde Vorhersagekraft von Tierversuchen entlarvt. Trotz zahlreicher „Tiermodelle“ und jahrzehntelanger Forschung gehört die Entwicklung neuer Krebsmedikamente nach wie vor zu den Bereichen mit den schlechtesten Erfolgsaussichten. In der Onkologie liegt die Versagensrate bei der tierversuchsbasierten Medikamentenentwicklung bei über 95 %.(16).
Bemerkenswert ist zudem, dass die höchste Abbruchquote klinischer Studien nach Phase-II-Tests auftritt, also dem Zeitpunkt, an dem die Wirksamkeit beim Menschen zum ersten Mal bewertet wird (17). Dies belegt, dass sich eine in Tierversuchen gefundene Wirksamkeit nicht auf den Menschen übertragen lässt. So werden „Tiermodelle“ wie das Xenotransplantat-Mausmodell, von vielen Wissenschaftlern als ein Haupthindernis bei der Entwicklung neuer Therapien gesehen (17).
Die wichtigsten Kritikpunkte im Kontext der Brustkrebsforschung werden im Folgenden zusammengefasst.
Unterschiede zwischen den Spezies
Die Biologie von Nagetieren und ihren Tumoren unterscheidet sich wesentlich von der des Menschen und von menschlichen Tumore (18). So ist die vollständige Reifung der Brustdrüsen bei Nagetieren von einer Schwangerschaft abhängig, beim Menschen jedoch nicht. Dies hat Auswirkungen auf die Anwesenheit von multipotenten Stammzellen, die eine Rolle bei der Entstehung von Brustkrebs spielen (18).
Auch können biologische Signalwege, Genexpressionen oder Stoffwechselprozesse bei Mäusen anders funktionieren als beim Menschen. Diese Unterschiede können zu Unterschieden in der Wirksamkeit und Toxizität von Medikamenten führen. Zum Beispiel stellen Mäuse kein dem humanem Interleukin-8 (IL-8) entsprechendes Molekül her, und die Funktion des Zytokins wird vermutlich von anderen Molekülen übernommen. IL-8 nimmt aufgrund seiner vielfältigen Funktionen jedoch eine zentrale Rolle bei der Krebsentstehung ein und hat einen erheblichen Einfluss auf die Tumormikroumgebung. Dies kann in Mäusen nicht nachvollzogen werden. Auch andere mögliche Zielstrukturen zur Bekämpfung von Krebs können sich bei Mäusen von denen des Menschen unterscheiden, ebenso wie der Metabolismus der Verbindung (15). Medikamente, die bei Mäusen wirksam und verträglich sind, erweisen sich somit in klinischen Studien häufig als ineffektiv oder sogar als schädlich.
Zudem werden Tierversuche überwiegend an genetisch einheitlichen Mäusen sogenannter Inzuchtlinien durchgeführt. Dadurch können die genetische Vielfalt der menschlichen Patienten sowie individuelle Unterschiede in der Reaktion auf Medikamente nicht berücksichtigt werden. Die Tiere sind jung, was ebenfalls nicht dem Patientenkollektiv entspricht.
Unterschiede in den Tumoren
Sporadische Krebserkrankungen sind bei Nagetieren selten. Die kürzere Lebensdauer von Nagetieren bedeutet, dass die in ihnen hervorgerufenen Tumore rasch voranschreiten müssen, damit sie in einem Tierversuch überhaupt erfasst werden können (18).
Dazu werden häufig aus der Maus stammende Krebszellen verwendet, die sich jedoch stark von menschlichen Tumorzellen unterscheiden. Beispielsweise ist etwa die Hälfte der menschlichen Brustkrebserkrankungen hormonabhängig, während die überwiegende Mehrheit der Maustumoren hormonunabhängig sind und viel weniger Hormonrezeptoren aufweisen als menschliche Tumore (19). Obwohl bei den Tumoren von Mäusen und Menschen ähnliche morphologische Muster zu beobachten sind, stimmt die detaillierte Struktur der meisten Maustumoren nicht mit den häufigsten menschlichen Brustkrebsarten überein. Auch Tumoren bei Ratten unterscheiden sich in ihrer detaillierten Histologie sowohl von Maus- als auch von menschlichen Tumoren. Zudem weichen die Metastasierungsmuster zwischen den verschiedenen Tierarten voneinander ab (18). Brustkrebs beim Menschen breitet sich in der Regel über das Lymphsystem aus, beginnend mit den nahegelegenen Lymphknoten. Danach bilden sich Fernmetastasen, vor allem in den Knochen, dem Gehirn, der Leber und der Lunge. Im Gegensatz dazu metastasieren Brusttumore bei Mäusen fast ausschließlich über den Blutweg in die Lunge (18).
Doch auch wenn menschliche Krebszelllinien verwendet werden, werden nur wenige menschliche Tumorzelllinien verwendet, die nicht die enorme genetische Vielfalt repräsentieren, die in tatsächlichen Tumoren bei Patienten zu finden ist. Diese Einschränkung kann den prädiktiven Wert dieser Modelle für klinische Ergebnisse zusätzlich beeinträchtigen (17). Menschliche Brusttumore unterscheiden sich stark voneinander und selbst innerhalb eines Tumors gibt es große Unterschiede. Auch dies kann unter Verwendung von aus Zelllinien stammenden Tumoren nicht berücksichtigt werden.
Unterschiede in der Umgebung des Tumors
Neben dem Tumor selbst unterscheidet sich auch seine Umgebung in Mäusen – oder anderen Tieren – erheblich von der im menschlichen Körper. Wenn menschliches Tumorgewebe oder Zelllinien in immundefiziente Mäuse (wie Nackt- oder SCID-Mäuse) transplantiert werden, entstehen sogenannte chimäre Tumoren, die ein Gemisch aus menschlichen Tumorzellen und murinem (also mausspezifischem) Stroma enthalten. Insgesamt weisen Xenotransplantate weniger Stromazellen auf, und das vorhandene Stroma stammt aus Mausgewebe. Diese chimären Tumoren können sich in ihrer Biologie stark von der eines menschlichen Tumors unterscheiden und zu unvorhersehbarem Wachstum oder veränderten Metastasierungseigenschaften führen. Eine weitere wesentliche Einschränkung, die alle Xenotransplantat-Modelle aufweisen, ist das Fehlen einer Immunantwort gegen die Tumorzellen. Zudem weisen die Wirtsmäuse (wie SCID und Nacktmäuse) tiefgreifende Defekte in ihrer Immunantwort auf, was die effektive Testung von immunmodulatorischen Wirkstoffen unmöglich macht (17).
Somit rekapitulieren „Tiermodelle“ die komplexen Wechselwirkungen zwischen dem Tumor und seiner Mikroumgebung, die das Ansprechen auf das Medikament erheblich beeinflussen können, nicht (17).
Obwohl viele genetisch veränderte Mäuse erzeugt wurden, ist es aufgrund der Einschränkungen von „Mausmodellen“ – einschließlich der Unterschiede in den molekularen Komponenten zwischen den Arten, den unterschiedlichen Genexpressionsprofilen und dem genetischen Hintergrund – nicht möglich, die mit diesen Modellen gewonnenen Erkenntnisse direkt für die Entwicklung von Arzneimitteln anzuwenden. Zudem zeigen die meisten genetisch veränderten Mäuse einen Ganzkörper-Phänotyp, bei dem alle Gewebe und Zellen denselben Gendefekt aufweisen. Sie ahmen also nicht die sporadischen Tumore nach, die durch eine Mutation entstehen, die nur eine einzelne Zelle in einer ansonsten normalen Umgebung betrifft (18).
Bereits vor 20 Jahren stellte Ismail Kola, Senior Vice President für Grundlagenforschung bei Merck Research Labs, fest, dass die hohen Fehlerquoten bei der Entwicklung neuer Krebsmedikamente darauf zurückzuführen sind, dass die verwendeten „Tiermodelle“ eine geringe Vorhersagekraft besitzen. Auch die in der Pharmaindustrie häufig eingesetzten Xenotransplantat-Modelle, bei denen eine Tumorzelllinie, die für den im menschlichen Körper wachsenden Tumor möglicherweise wenig relevant ist, in eine Nacktmaus injiziert wird, tragen zu diesem Problem bei. Diese Modelle spiegeln weder das Immunsystem des Menschen wider, noch ähnelt die künstliche Platzierung des Tumors dem, was während der tatsächlichen Tumorentstehung im Körper passiert (20).
Gefangen im System Tierversuch?
Was schließen die Forscher aus all diesen Belegen zum Scheitern der tierversuchsbasierten Krebsforschung? Nicht, dass eine Abkehr vom Tierversuch und eine Hinwendung zu ausschließlich humanbasierten Methoden erforderlich sind. Vielmehr wird vorgeschlagen, die Limitationen der verschiedenen „Tiermodelle“ durch die Kombination mehrerer Modelle zu überwinden (5). Auch sollen die vorhandenen „Tiermodelle“ weiter verfeinert werden. Der Hoffnung, dass durch die Kombination verschiedener „Tiermodelle“ die „Vorteile“ einzelner Modelle genutzt und ihre Nachteile umgangen werden können, steht die Tatsache gegenüber, dass die Übertragbarkeit von Tierversuchen auf den Menschen erst rückwirkend beurteilt werden kann – also erst, wenn Versuche am Menschen bereits durchgeführt wurden. Dadurch wird die Kombination unterschiedlicher Modelle zu noch mehr Tierversuchen führen, ohne das grundlegende Problem der mangelnden Übertragbarkeit auf den Menschen zu lösen.
Einige Forscher argumentieren, dass Xenotransplantat-Modelle trotz ihrer schlechten Erfolgsbilanz nützlich für die Entwicklung von Krebsmedikamenten seien. Sie behaupten, dass Wirkstoffe, die in diesen Studien versagen, wahrscheinlich auch beim Menschen keine Wirkung zeigen würden. Diese Annahme wurde jedoch nie nachgewiesen und wirft die beunruhigende Möglichkeit auf, dass vielversprechende therapeutische Wirkstoffe in der präklinischen Phase aufgrund mangelnder Aktivität in Tierversuchen fälschlicherweise verworfen werden (17).
Unzählige Tiere leben, leiden und sterben für eine fragwürdige Forschung, deren Erfolge weit hinter den Erwartungen zurückbleiben. Auf der anderen Seite warten Patienten und ihre Angehörigen auf eine lebensrettende Therapie. Doch neue Medikamente bieten kaum eine Heilung, sondern oft nur eine geringfügige Lebensverlängerung, die zum Preis von zum Teil schweren Nebenwirkungen erkauft werden muss. Gleichzeitig sind Tierversuche zeitaufwändig und teuer und treiben somit sowohl die Entwicklungskosten als auch -dauer in die Höhe.
Daher stellen immer mehr Wissenschaftler fest, dass sich die Verwendung von Tierversuchen bei Entwicklung von Krebsmedikamenten als problematisch erwiesen hat und zu vielen bemerkenswerten Misserfolgen geführt hat (17). Angesichts dieser verheerenden Bilanz drängt sich die Frage auf, ob das Festhalten am System Tierversuch nicht ganz wesentlich dazu beiträgt oder sogar ursächlich dafür ist, dass viele Patienten noch immer vergebens auf neue Therapien warten. So entwickeln immer mehr Wissenschaftler tierversuchsfreie Methoden für die Krebs- und Brustkrebsforschung, die effizienter, ethischer und auf den Menschen übertragbar sind.
Tierversuchsfreie Forschungsmethoden
Die Entwicklung tierversuchsfreier Methoden hat in den letzten Jahren bedeutende Fortschritte gemacht. Es gibt mittlerweile eine Vielzahl tierversuchsfreier Ansätze zur Erforschung von Brustkrebs. Das Referenzlabor EURL ECVAM (European Centre for the Validation of Alternative Methods) veröffentlichte bereits 2020 eine Sammlung von 935 tierversuchsfreien Methoden zur Untersuchung von Brustkrebs (21). Auch unsere NAT-Datenbank liefert derzeit (06.01.2025) bereits 215 tierversuchsfreie Methoden zum Thema Brustkrebs (22). Die wichtigsten tierversuchsfreien Methoden werden im Folgenden kurz anhand einiger Beispiele erläutert.
Zellkulturversuche
In der präklinischen Forschung, also bei der Entwicklung und Testung potenzieller Krebstherapien, werden neben Tierversuchen auch bereits zellbasierte Verfahren eingesetzt. Häufig kommen dabei einfache Zellmodelle zum Einsatz, wie zum Beispiel menschliche Brustkrebszellen, die entweder auf Zellkulturoberflächen wachsen oder als kleine Mini-Tumore in Form von Organoiden untersucht werden. Diese Modelle sind einfach und kostengünstig und ermöglichen es beispielsweise zu testen, ob ein potenzieller Wirkstoff das Absterben der Krebszellen verursacht (4). Allerdings fehlt diesen Systemen die nötige Komplexität, da sie rein auf die Tumorzellen fokussiert sind und die natürliche Umgebung des Tumors wie benachbarte Zellen unberücksichtigt lassen.
Um diese Einschränkungen zu überwinden, wurden humanbasierte Techniken entwickelt, die es ermöglichen, sowohl die direkte Tumorumgebung als auch die systemischen Wechselwirkungen des zu testenden Wirkstoffs mit verschiedenen Organen zu berücksichtigen.
Organoide
Organoide sind dreidimensionale Zellkulturen, die aus menschlichem Gewebe gewonnen werden und die Struktur sowie Funktion von Organen nachbilden. Brustkrebs-Organoide ermöglichen die Untersuchung von Tumorwachstum, Metastasierung und der Wirkung von Medikamenten im menschlichen Kontext. Besonders vielversprechend sind patientenabgeleitete Organoide (Patient-derived Organoids, PDOs), da sie aus primären menschlichen Tumoren stammen, wodurch der komplexe Aufbau und die Heterogenität des Tumors erhalten bleiben. Hierbei wird das Tumorgewebe, das in der Regel aus chirurgischen Entnahmen oder Nadelbiopsien stammt, in einzelne Zellen zerlegt, die anschließend kultiviert werden, um dreidimensionale (3D) Strukturen zu bilden. (23).
Dabei lassen sich nicht nur Tumor-Organoide herstellen, sondern auch solche, die gesundes Brustgewebe nachbilden (24). Außerdem können menschliche induzierte pluripotente Stammzellen (hiPSCs) genutzt werden, um Organoide aus Brustgewebe zu erzeugen. Diese Organoide ahmen die Eigenschaften menschlichen Brustgewebes nach und konnten sogar zur Produktion von Milcheiweiß angeregt werden. Die aus hiPSCs gewonnenen Brust-Organoide können beispielsweise eingesetzt werden, um zu untersuchen, wie verschiedene Faktoren die Entstehung von Brustkrebs beeinflussen (25).
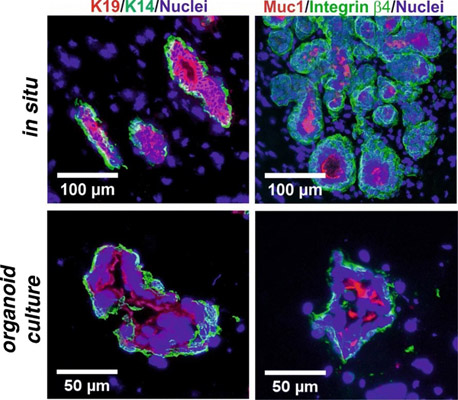
Brustorganoide (unten) bilden gesundes Brustgewebe (oben) nach. Quelle: Golhammer et al. Breast Cancer Res. 2019 (24).
Es ist auch möglich, bei Organoiden die Tumormikroumgebung zu modellieren, indem weitere Zelltypen wie normale Brustepithelzellen, Fettzellen, Fibroblasten oder Immunzellen integriert werden. Dies erhöht die Komplexität und Relevanz des Organoid-Modells (23). Insgesamt stellen Brustkrebs-Organoide ein leistungsfähiges Modellsystem dar, das die Untersuchung von Krankheitsmechanismen und die Erprobung therapeutischer Reaktionen an ausschließlich menschlichem Material ermöglicht.
Organ-on-a-Chip Systeme
Diese Technologie verwendet kleine Chips, die menschliche Gewebe- und Organsysteme simulieren. Dazu werden Zellen oder Gewebe unterschiedlicher Organe – bspw. in Form von Organoiden - in kleinen Kammern kultiviert, wobei die Kammern über feine Kanäle miteinander verbunden sind. Über die Kanäle werdenBlutgefäße imitiert und Studien zur Bewertung der Metastasierung von Tumorzellen ermöglicht. Organchips können verwendet werden, um die Wirkung von Medikamenten unter nahezu realistischen Bedingungen zu testen.
Beispielsweise spielt Fettgewebe eine entscheidende Rolle bei Brustkrebs. Fettzellen beeinflussen Tumorzellen, sie stoßen Signalstoffe aus, die benachbarte Tumorzellen und ihren Stoffwechsel beeinflussen. Über diese Mechanismen können Fettzellen zur Entstehung, zum Wachstum und Metastasierung von Brustkrebs beitragen (26). Vor diesem Hintergrund wird von menschlichen Spendern stammendes Fettgewebe in Organchips integriert. Durch Verwendung von Fettgewebe unterschiedlicher Spender, die sich in Alter, Herkunft und Ernährungszustand voneinander unterscheiden, kann untersucht werden, wie unterschiedliche Fettarten sich auf Brustkrebs auswirken und mit ihm wechselwirken. Im Jahr 2023 hat ÄgT den mit 20.000 Euro dotierten Herbert-Stiller-Preis an Prof. Dr. Peter Loskill von der Eberhard Karls Universität Tübingen verliehen. In dem prämierten Projekt wird ein Brustkrebs-auf-dem-Chip-Modell entwickelt. Dabei werden patientenspezifische Brustkrebs-Organoide zusammen mit Fettgewebe in einer Umgebung gezüchtet, die der menschlichen Brust ähnelt. Proben von verschiedenen Patientinnen (z. B. gesund, fettleibig, in den Wechseljahren) werden verwendet, um spezifische Krebsprozesse zu erforschen (27).
In Organchips können auch noch weitere Zellen integriert werden. Beispielsweise erlauben menschliche Immunzellen die Berücksichtigung des Einflusses des Immunsystems auf den Tumor und seine Behandlung. Auch die Verstoffwechselung von Wirkstoffen und ihre Verteilung in verschiedenen Organen und Geweben kann in Multi-Organ-Chips untersucht werden. Ebenso wurden Organchips bereits erfolgreich zur Testung der Toxizität untersucht (28).
3D-gedruckte Modelle
Die Nachbildung der komplexen Mikroarchitektur der Brust ist entscheidend für das Verständnis von Brustkrebs. Fortschritte im 3D-Druck haben die Entwicklung anpassbarer Modelle ermöglicht, darunter Systeme, die Gefäßstrukturen, Haut, Lunge, Niere, Knorpel und Gehirn nachahmen. In den letzten Jahren wurden auch biogedruckte Modelle für Brust-, Gehirn-, Eierstock- und Hautkrebs entwickelt und optimiert (26). Beim 3D-Druck werden Materialien zur Erstellung dreidimensionaler Strukturen schichtweise aufgetragen. Häufig werden Materialien wie Alginat oder Hydrogele verwendet, die mit Zellen besiedelt werden.
Ein Beispiel ist das von Dance et al. entwickelte Modell, das menschliche Brusttumore mit Kollagen-Gelen und einem Stroma aus Fettzellen sowie in Fettgewebe vorkommenden Stammzellen nachbildet. Zusätzlich enthält das Modell dem Lymphsystem ähnliche Hohlräume, um die Invasion von Krebszellen und die Metastasierung zu untersuchen (29). Horder et al. erzeugten hingegen Sphäroide aus in Fettgewebe vorkommenden Stammzellen in einer hyaluronsäurebasierten Bio-Tinte. Die Stammzellen wurden in Fettzellen differenziert und mit Brustkrebszellen besiedelt, um ein adipöses Brustkrebsgewebe zu modellieren (30).
In präklinischen Studien ermöglichen 3D-gedruckte Modelle die Integration mehrerer Zelltypen und die Nachbildung physiologisch relevanter Gewebestrukturen. Die Automatisierbarkeit der Technologie unterstützt zudem die effiziente und reproduzierbare Herstellung der Modelle (26). Durch Integration von verschiedenen menschlichen Zellen und Strukturen können Tumor-Organoide in einer physiologisch relevanten Umgebung untersucht werden.
Computergestützte Modelle und KI
Computermodelle und Künstliche Intelligenz (KI) spielen eine immer wichtigere Rolle in der Krebsforschung. Sie können verwendet werden, um Daten aus klinischen Studien zu analysieren und präzise Vorhersagen über die Wirkung von Medikamenten zu treffen.
Genetische Algorithmen wurden für die Diagnose von Brustkrebs bereits umfassend erforscht. Computergestützte Methoden und Algorithmen wurden auch eingesetzt, um die molekularen Mechanismen von Brustkrebs zu verstehen, Arzneimittelresistenzen vorherzusagen und neue Biomarker für eine wirksame Behandlung zu finden (31). KI kann beispielsweise auch die Vorhersage des Ansprechens auf eine präoperative Chemotherapie verbessern (32).
KI wird auch bei der Entwicklung von Wirkstoffstrukturen eingesetzt. Computergestützte Methoden wie molekulares Docking und maschinelles Lernen werden verwendet, um mögliche Wirkstoffkandidaten zu identifizieren. In-silico-Untersuchungen und Deep-Learning-Techniken werden eingesetzt, um molekulare Mechanismen, pharmakokinetische Eigenschaften und die Sicherheit potenzieller Medikamente vorherzusagen (33).
KI hat somit ein großes Potenzial, die Erkennung, Diagnose und Behandlung von Brustkrebs zu verbessern. Durch die Analyse riesiger Datenmengen können KI-Algorithmen dabei Muster und Anomalien identifizieren, die für menschliche Beobachter möglicherweise nicht erkennbar sind.
Präzisere Waffen im Kampf gegen Krebs: zielgerichtete Therapien
Zielgerichtete Therapien stellen eine vielversprechende Behandlungsoption für Brustkrebs dar. Bei diesen Therapien werden Tumorzellen gezielt angegriffen oder in ihrem Wachstum gehemmt, während gesunde Zellen weitgehend verschont bleiben. Dadurch bieten zielgerichtete Therapien das Potenzial für eine hohe Wirksamkeit bei gleichzeitiger Reduzierung von Nebenwirkungen. Die Entwicklung solcher Therapien für Brustkrebs ist jedoch anspruchsvoll, da sie darauf abzielen, spezifische molekulare Signalwege oder genetische Anomalien zu blockieren, die das Tumorwachstum fördern. Dabei stößt die herkömmliche tierversuchsbasierte Forschung schnell an ihre Grenzen: Viele molekulare Mechanismen, die bei der Tumorentstehung im menschlichen Körper eine Rolle spielen, sind bei Tieren nicht vorhanden oder anders reguliert, was den Einsatz von Tierversuchen nicht zielführend macht. Zudem sind viele zielgerichtete Therapien darauf ausgelegt, mit bestimmten Komponenten des menschlichen Immunsystems zu interagieren. Da das Immunsystem von Tieren anders funktioniert oder bspw. bei PDX-Modellen nicht richtig arbeitet, können solche Wechselwirkungen in Tierversuchen nicht angemessen getestet werden.
Aus diesen Gründen sind humanbasierte Forschungsmethoden unverzichtbar, um zielgerichtete Therapien zu entwickeln. Patientenspezifische Modelle, wie aus Tumorproben entwickelte Brustkrebs-Organoide, bieten eine vielversprechende Lösung.
Patienteneigene Brustkrebs-Organoide eignen sich auch, um zu untersuchen, auf welche Therapie ein bestimmter Tumor am besten anspricht. So kann eine möglichst wirksame Therapie für den jeweiligen Patienten ausgewählt werden. Dabei zeigt sich der Vorteil tierversuchsfreier Methoden besonders deutlich: Sie ermöglichen nicht nur Ergebnisse, die auf den Menschen übertragbar sind, sondern sogar eine personalisierte Medizin, die individuell auf einzelne Patienten abgestimmt ist. Weitere Informationen zu den Möglichkeiten der personalisierten Krebstherapie finden Sie in unserem Beitrag Personalisierte Krebstherapie (34).
Prävention
Ein zentrales Ziel der Brustkrebsforschung ist es, die Ursachen der Krankheit zu verstehen. Dazu gehört die Identifizierung von genetischen Risikofaktoren durch molekulare Analysen. Mit epidemiologischen Studien konnten auch Umwelt- und Lebensstilfaktoren für Brustkrebs identifiziert werden. Diese Faktoren lassen sich beeinflussen und stellen somit die Grundlage der Prävention von Brustkrebs dar.
Rauchen, Alkohol, Ernährung und Bewegungsmangel sind wichtige Faktoren, die das Risiko an Brustkrebs zu erkranken erhöhen und sich durch eine entsprechende Lebensstilanpassung vermeiden lassen. Insbesondere stellt der Alkoholkonsum einen wesentlichen und vermeidbaren Risikofaktor für das Erkranken an Brustkrebs dar und ist für 7 % der neuen Brustkrebsfälle verantwortlich (35). Bei Alkohol gibt es entgegen der landläufigen Meinung keine gesundheitlich unbedenkliche Menge und der Verzicht auf Alkohol kann das Risiko für Brustkrebs und weitere Erkrankungen nachweislich senken (36). Detaillierte Informationen zur Prävention haben wir in unserem Beitrag ´Prävention von Krebs´ zusammengefasst (37).
Fazit
Die Brustkrebsforschung steht an einem Wendepunkt. Während Tierversuche jahrzehntelang als unverzichtbar galten und noch immer als ´Goldstandard´ gelten, wird zunehmend klar, dass sie den Fortschritt behindern. Der hohe Anteil unwirksamer oder unsicherer Wirkstoffe, die in klinische Studien aufgenommen werden, belegt, dass bessere Methoden zur Vorhersage der Wirksamkeit erforderlich sind. Mit Technologien wie Organoiden, Organ-on-a-Chip-Systemen und künstlicher Intelligenz können Wissenschaftler für den Menschen relevante Erkenntnisse gewinnen, die zu besseren Behandlungsmöglichkeiten für Brustkrebs führen werden.
08.01.2025
Dr. rer. nat. Johanna Walter
Quellen
- Zentrum für Krebsregisterdaten, Brustkrebs (Mammakarzinom), 30.09.2024
- Statistisches Bundesamt,Häufigste Todesursachen von Frauen, 2025
- ONKO Internetportal, Zielgerichtete Therapie beim Brustkrebs, 27.07.2022
- Walter J. Krebs: Tierversuche und tierversuchsfreie Forschung, Ärzte gegen Tierversuche, 09.03.2023
- Zeng L. et al. Breast cancer animal models and applications. Zoological Research 2020; 41(5):477–494
- Plante I. Methods in Cell Biology, Elsevier, 2021, Vol. 163, 21–44
- Rivina L. et al. Mouse models for radiation-induced cancers. Mutagenesis 2016; 31(5):491–509
- Chakrabarti R. et al. Mouse Models of Cancer, Methods in Molecular Biology, Springer New York, 2015, Vol. 1267, 367–380
- Li Z. et al. Application of Animal Models in Cancer Research: Recent Progress and Future Prospects. Cancer Management and Research 2021; Volume 13:2455–2475
- Mercatali L. et al. Development of a Patient-Derived Xenograft (PDX) of Breast Cancer Bone Metastasis in a Zebrafish Model. International Journal of Molecular Sciences 2016; 17(8):1375
- Nguyen F. et al. Canine invasive mammary carcinomas as models of human breast cancer. Part 1: natural history and prognostic factors. Breast Cancer Research and Treatment 2018; 167(3):635–648
- Razavirad A. et al. Canine Mammary Tumors as a Potential Model for Human Breast Cancer in Comparative Oncology. Veterinary Medicine International 2024; 2024(1):9319651
- Deycmar S. et al. Spontaneous, naturally occurring cancers in non-human primates as a translational model for cancer immunotherapy. Journal for Immunotherapy of Cancer 2023; 11(1):e005514
- Mondal P. et al. Large Animal Models of Breast Cancer. Frontiers in Oncology 2022; 12:788038
- Smith B.F. et al. An in utero allotransplantation model of metastatic breast cancer in the cat. In Vivo (Athens, Greece) 2003; 17(1):35–39
- Biomedtracker, Why Are Clinical Development Success Rates Falling?, 29.04.2024
- Sharpless N.E. et al. The mighty mouse: genetically engineered mouse models in cancer drug development. Nature Reviews Drug Discovery 2006; 5(9):741–754
- Kim J.B. et al. Models of breast cancer: is merging human and animal models the future? Breast Cancer Research 2003; 6(1):22
- Nandi S. et al. Hormones and mammary carcinogenesis in mice, rats, and humans: a unifying hypothesis. Proceedings of the National Academy of Sciences 1995; 92(9):3650–3657
- Kola I. et al. Can the pharmaceutical industry reduce attrition rates? Nature Reviews Drug Discovery 2004; 3(8):711–716
- European Commission, Joint Research Centre, Advanced non-animal models in biomedical research, Publications Office, 2020
- NAT-Datenbank
- Li X. et al. Advances in breast cancer organoid for individualized treatment. Organs-on-a-Chip 2023; 5:100028
- Goldhammer N. et al. Characterization of organoid cultured human breast cancer. Breast Cancer Research 2019; 21(1):141
- Qu Y. et al. Differentiation of Human Induced Pluripotent Stem Cells to Mammary-like Organoids. Stem Cell Reports 2017; 8(2):205–215
- Hamel K.M. et al. Adipose Tissue in Breast Cancer Microphysiological Models to Capture Human Diversity in Preclinical Models. International Journal of Molecular Sciences 2024; 25(5):2728
- Herbert-Stiller-Preis 2023 für tierversuchsfreie Forschung geht an Wissenschaftler aus Tübingen und Krems, Pressemitteilung von Ärzte gegen Tierversuche, 05.10.2023
- Ewart L. et al. Performance assessment and economic analysis of a human Liver-Chip for predictive toxicology. Communications Medicine 2022; 2(1):154
- Dance Y.W. et al. Adipose Stroma Accelerates the Invasion and Escape of Human Breast Cancer Cells from an Engineered Microtumor. Cellular and Molecular Bioengineering 2022; 15(1):15–29
- Horder H. et al. Bioprinting and Differentiation of Adipose-Derived Stromal Cell Spheroids for a 3D Breast Cancer-Adipose Tissue Model. Cells 2021; 10(4):803
- Khan A. et al. Editorial: Breast cancer resistance, biomarkers and therapeutics development in the era of artificial intelligence. Frontiers in Molecular Biosciences 2022; 9:1034990
- Taylor C.R. et al. Artificial Intelligence Applications in Breast Imaging: Current Status and Future Directions. Diagnostics (Basel, Switzerland) 2023; 13(12):2041
- Nafissi N. The Application of Artificial Intelligence in Breast Cancer. Eurasian Journal of Medicine and Oncology 2024; doi: 10.14744/ejmo.2024.45903:235–244
- Walter J. Personalisierte Krebstherapie, Ärzte gegen Tierversuche, 08.03.2024
- World Health Organization, Alkohol ist einer der größten Risikofaktoren für Brustkrebs, 20.10.2021
- World Health Organization, Beim Alkoholkonsum gibt es keine gesundheitlich unbedenkliche Menge, 04.01.2023
- Walter J. Prävention von Krebs, Ärzte gegen Tierversuche, 08.04.2024
